1、填空题 (17分)Na、Cu、Al、O、C、H是常见的六种元素。
(1)Al位于元素周期表第_____周期第_____族;Cu的基态原子价电子排布式为__________。
(2)用“>”或“<”填空:
第一电离能
| 离子半径
| 沸点
|
Na_______Al
| O2—_______Na+
| CH4______H2O
|
(3)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物 质
| CH4
| CO2
| CO
| H2
|
体积分数
| 0.1
| 0.1
| 0.4
| 0.4
|
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=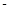 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="+2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=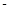 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________.

②为了提高该反应中CH4的转化率,可以采取的措施是__________________
(5)利用高温电解技术可将释放的CO2转化为具有工业利用价值的产品。
反应方程式为: ,其工作原理示意图如下:
,其工作原理示意图如下:

CO2在电极a放电的反应式是_______________________________
参考答案:(17分)
(1)三(1分) ⅢA (1分) 3d104s1 (2分)
(2)< 、 > 、 < (各1分)
(3)①64 mol2?L-2(单位不要求)(2分) ②+247.3 kJ·mol-1 (2分)
(4)①温度超过250℃时,催化剂的催化效率降低(2分)
②增大反应压强或增大CO2的浓度(2分)
(5)CO2 + 2e- ="=" CO+O2- (2分)
本题解析:(1)Al位于元素周期表第三周期,第IIIA族;Cu的的基态原子价电子即外围电子排布式为3d104s1;
(2)Na的金属性比Al强,所以第一电离能Na<Al;O2-与Na+的核外电子排布相同,但O的核电荷数少,所以离子半径O2->Na+;水分之间可以形成氢键,甲烷不可以,所以甲烷的沸点<水的沸点;
(3)①根据CO2 (g)+CH4(g)  2CO(g)+2H2(g),及平衡时各气体的体积分数可知,设消耗二氧化碳的物质的量是xmol,则平衡时二氧化碳的物质的量是(6-x)mol,甲烷的物质的量也是(6-x)mol,生成CO、氢气的物质的量是2xmol,所以(6-x)/(6-x+6-x+2x+2x)=0.1,所以x=4,所以平衡时各气体的物质的量浓度二氧化碳、甲烷都是(6-4)/4mol/L=0.5mol/L,CO、氢气的浓度都是8/4mol/L=2mol/L,所以平衡常数K=(22mol/L×22mol/L)/(0.5mol/L×0.5mol/L)=64 mol2?L-2;
2CO(g)+2H2(g),及平衡时各气体的体积分数可知,设消耗二氧化碳的物质的量是xmol,则平衡时二氧化碳的物质的量是(6-x)mol,甲烷的物质的量也是(6-x)mol,生成CO、氢气的物质的量是2xmol,所以(6-x)/(6-x+6-x+2x+2x)=0.1,所以x=4,所以平衡时各气体的物质的量浓度二氧化碳、甲烷都是(6-4)/4mol/L=0.5mol/L,CO、氢气的浓度都是8/4mol/L=2mol/L,所以平衡常数K=(22mol/L×22mol/L)/(0.5mol/L×0.5mol/L)=64 mol2?L-2;
②根据盖斯定律,将已知热化学方程式中的氧气、水消去,得到CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=(
2CO(g)+2H2(g) 的△H=(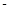 890.3 kJ·mol-1)+2×(+2.8 kJ·mol-1)-2×(-566.0 kJ·mol-1)="+247.3" kJ·mol-1
890.3 kJ·mol-1)+2×(+2.8 kJ·mol-1)-2×(-566.0 kJ·mol-1)="+247.3" kJ·mol-1
(4)①温度超过250℃时,催化剂的催化效率降低,所以乙酸的生成速率降低;
②为了提高该反应中CH4的转化率,可以增大压强,或增大二氧化碳的浓度,使反应向生成乙酸的方向进行,甲烷的转化率提高;
(5)电极a与电源负极相连,所以a是阴极,发生还原反应,所以二氧化碳转化为CO和O2-,电极反应式为CO2 + 2e- ="=" CO+O2-。
考点:考查元素周期表的应用,元素性质的应用,平衡常数的计算,盖斯定律的应用,电极反应式的书写
本题难度:困难
2、填空题 在下列事实中,什么因素影响了化学反应的速率??
(1)集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸______________;
(2)黄铁矿煅烧时要粉碎成细小的矿粒__________________;
(3)KI晶体和HgCl2晶体混合后无明显现象,若一起投入水中,很快生成红色HgI2________________;
(4)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体__________________;
(5)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢__________________;
(6)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同_______________;
(7)夏天的食品易变霉,冬天就不易发生该现象__________________。
参考答案:(1)光
(2)反应物的接触面积
(3)在溶液中,水作溶剂,增大了接触面积
(4)催化剂
(5)反应物本身的性质
(6)反应物的浓度
(7)反应温度
本题解析:
本题难度:一般
3、填空题 “碘钟”实验中,3I- +S2O82- =I3-+ 2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表,回答下列问题:
(1)该实验的目的是____________。
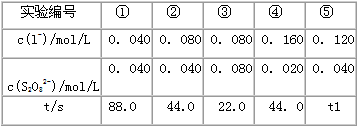
(2)显色时间t1=_____________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间
t2 的范围为__________(填字母)。
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是__________________。
参考答案:(1)研究反应物I-与S2O42-的浓度对反应速率的影响
(2)29.3s
(3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度成反比)
本题解析:
本题难度:一般
4、填空题 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______________。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_______________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
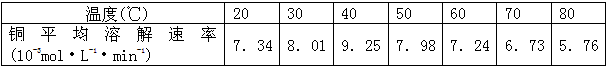
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是________________________________________________________________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是____________________________。
参考答案:(1)BD
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68kJ.mol-1
(3)H2O2分解速率加快
(4)2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
本题解析:
本题难度:一般
5、填空题 在一定温度下,在一个容积为2L的密闭容器中,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g) 2SO3(g) ;△H=-196.6kJ·mol-1 在反应进行至10min和20min时,改变了影响反应的一个条件,反应进程如图所示。
2SO3(g) ;△H=-196.6kJ·mol-1 在反应进行至10min和20min时,改变了影响反应的一个条件,反应进程如图所示。

(1)前10min正反应速率变化趋势是_____________(填增大、减小或不变)前15min平均反应速率用SO3浓度变化可表示为:____________________。
(2)在如图所示的反应进程中,表示正反应速率与逆反应速率相等的时间段是________________。
(3)据图判断:10min时改变的反应条件可能是____________(填写编号,下同); 20min时改变的反应条件可能是____________。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加O2的物质的量
参考答案:(1)减小;0.04/30mol·L-1·min-1
(2)15~20min,25~30min
(3)ab;d
本题解析:
本题难度:困难