1、简答题 某同学想在实验室用加热固体的方法制取一瓶氨气,并进行喷泉实验.他设计的实验装置如图所示(图2中的夹持装置已略去).
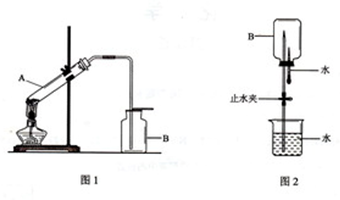
(1)图1所示装置中的错误为______.
(2)将图1所示装置中的错误改正后进行实验,试管A中所发生反应的化学方程式为______.一段时间后,将一端蘸有浓盐酸的玻璃棒接近集气瓶口,产生大量白烟,该反应的化学方程式为______.
(3)将已收集满氨气的集气瓶B,按图2所示连接好装置进行喷泉实验时,引发水上喷的操作是______
______;基预先在水中滴加少量酚酞溶液,则会观察到______色的喷泉.
(4)浓氨水可用于检验氯气管道是否漏气,其原理是8NH3+3Cl2=6NH4Cl+N2.在该反应中,当生成标准状况下11.2LN2时,被氧化的物质的质量是______g.
参考答案:(1)固体加热需要试管口略向下倾斜,防止市场的水倒流回试管底部炸裂试管,氨气是比空气轻的极易溶于水的气体,需要用向下排气法收集,装置中的粗物是:大试管管口向上倾斜,集气瓶中收集氨气向上排气法收集;
故答案为:大试管管口向上倾斜,集气瓶中收集氨气向上排气法收集;
(2)实验室用熟石灰和氯化铵在加热条件下反应制备氨气,反应的化学方程式为Ca(OH)2+2NH4Cl△.CaCl2+2NH3↑+2H2O,一段时间后,将一端蘸有浓盐酸的玻璃棒接近集气瓶口,产生大量白烟,该反应的化学方程式为:NH3+HCl=NH4Cl;
故答案为:Ca(OH)2+2NH4Cl△.CaCl2+2NH3↑+2H2O;NH3+HCl=NH4Cl;
(3)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,
故答案为:打开止水夹,挤出胶头滴管中的水;氨极易溶解于水生成一水合氨是弱碱,溶液中存在电离平衡,电离出的氢氧化根离子显碱性,遇到酚酞变红色,所以观察到红色喷泉;
故答案为:打开止水夹,挤出胶头滴管中的水,红;
(4)浓氨水可用于检验氯气管道是否漏气,其原理是8NH3+3Cl2=6NH4Cl+N2.在该反应中,当生成标准状况下11.2LN2时,物质的量=11.2L22.4L/mol=0.5mol,依据化学方程式分析氮元素化合价从-3价变化为0价,氨气被氧化,每生成1molN2,被氧化的氨气物质的量为2mol,所以生成0.5molN2,被氧化的氨气物质的量为1mol,质量=17g/mol×1mol=17g,
故答案为:17.
本题解析:
本题难度:简单
2、实验题 实验室用电石和水反应制取的乙炔气体中含有少量H2S 气体,为了净化和检验乙炔气体,并根据乙炔的体积计算电石的纯度,按下列要求填空(注意:X溶液为150?g含溴 3.2%的四氯化碳溶液)。
(1)试从如图所示装置中选用几种必要的装置,把它们连成一套装置,这些被选用的装置接口编号连接顺序是_________________。
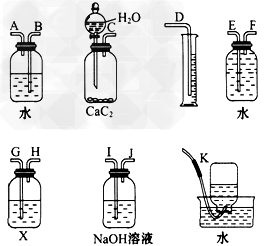
(2)实验室能否用启普发生器制乙炔?其原因是_________________。
(3)为了得到比较平稳的乙炔气流,常可用__________代替水。
(4)假设溴水与乙炔完全反应,生成C2H2Br4,用W?g的电石与水反应后,测得排入量筒内液体体积为V?mL(标准状况下),则电石纯度计算式为_______________。
参考答案:(1)C、I、J、G、H、F、E、D
(2)不能。反应非常剧烈,放出热量多,生成的Ca(OH)2微溶于水,形成悬浊液,易堵塞球形漏斗下端,容易发生爆炸,电石易变成粉末
(3)饱和食盐水?
(4)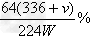
本题解析:
本题难度:一般
3、简答题 某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去).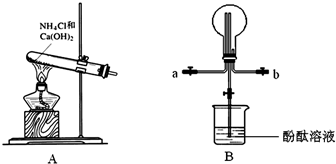
请回答:
(1)实验室制备氨气的化学方程式为______.
(2)收集氨气时,氨气的进气口应为______(填“a”或“b”).
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是______.
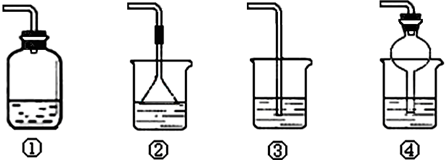
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是______(填序号).
参考答案:(1)实验室制取氨气是用氯化铵和氢氧化钙固体加热生成氨气和氯化钙、水,其化学方程式是:2NH4Cl+Ca(OH)2△.2NH3↑+CaCl2+2H2O;
故答案为:2NH4Cl+Ca(OH)2△.2NH3↑+CaCl2+2H2O;
(2)由于氨气密度比空气的小,a进气口是向下排空气,
故答案为:a;
(3)氨气极易溶于水,可以完成喷泉实验,氨水是弱碱,能够电离出氢氧根离子,
故答案为:极易溶于水,与水反应生成碱;
(4)因为氨气极易溶于水,吸收多于的氨气装置,必须能够防止倒吸,②④装置中的倒置的漏斗和球形干燥管的体积较大,能防止液体倒吸进入反应装置,
故答案为:②④.
本题解析:
本题难度:简单
4、实验题 在工业上,氯气是一种重要的化工原料;在实验室中,氯气和氯水是重要的化学试剂。
(1)资料显示,漂白粉在酸性(如硫酸)条件下可发生反应并生成氯气,有关反应的化学方程式为 Ca(ClO)2+CaCl2+2H2SO4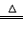 2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是__(填字母序号)。

②证明乙装置中FeCl2与Cl2发生了氧化还原反应的方法是___。
③丙装置中通入少量的Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强 于次氯酸,则丙中发生反应的化学方程式是___。
④该实验存在一个明显的缺陷,改进的方法是___
(2)某同学设计了一个实验方案以证明新制氯水中含有次氯酸。他所用的试剂如下:新制氯水、 0.5 mol.L-1的CaCl2溶液、品红溶液、CaCO3粉末,请你协助他完成实验方案。
步骤一:取5 mL 0.5 mol.L-1的CaCl2溶液于试管中,滴入3滴品红溶液,振荡,溶液不褪色。
步骤二:取5 mL新制氯水于试管中,___。
步骤三:____。 说明新制氯水中存在次氯酸的实验现象是___。设计步骤一的理由是___。
参考答案:(1)①c;
②取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN 溶液,若溶液变红色,则证明生成了Fe3+,从而说明了FeCl2与 Cl2发生了氧化还原反应
③Cl2 +2Na2 CO3+ H2O=NaCl+ NaClO+2NaHCO3
④在丙装置后连接一个盛有NaOH溶液的洗气瓶(合理即可)
(2)加入碳酸钙粉末充分反应至溶液无色; 取步骤二中的上层清液于另一试管中,加入3滴品红溶液,振荡; 品红溶液褪色;氯水与碳酸钙反应后生成氯化钙溶液(实质是氯水中的HCl与CaCO3反应,而HClO不与CaCO3反应),为证明品红溶液褪色是次氯酸的作用,须设计实验证明氯化钙溶液不具有漂白性(或“排除氯化钙溶液的干扰”)
本题解析:
本题难度:困难
5、选择题 实验室制备下列气体,可以使用HNO3的是
A.H2
B.O2
C.NO2
D.NH3
参考答案:C
本题解析:
本题难度:困难