1、简答题 某同学想在实验室用加热固体的方法制取一瓶氨气,并进行喷泉实验.他设计的实验装置如图所示(图2中的夹持装置已略去).
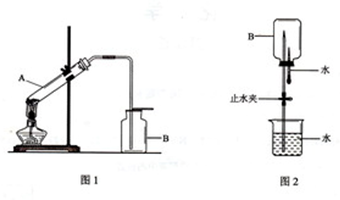
(1)图1所示装置中的错误为______.
(2)将图1所示装置中的错误改正后进行实验,试管A中所发生反应的化学方程式为______.一段时间后,将一端蘸有浓盐酸的玻璃棒接近集气瓶口,产生大量白烟,该反应的化学方程式为______.
(3)将已收集满氨气的集气瓶B,按图2所示连接好装置进行喷泉实验时,引发水上喷的操作是______
______;基预先在水中滴加少量酚酞溶液,则会观察到______色的喷泉.
(4)浓氨水可用于检验氯气管道是否漏气,其原理是8NH3+3Cl2=6NH4Cl+N2.在该反应中,当生成标准状况下11.2LN2时,被氧化的物质的质量是______g.
2、实验题 实验室用电石和水反应制取的乙炔气体中含有少量H2S 气体,为了净化和检验乙炔气体,并根据乙炔的体积计算电石的纯度,按下列要求填空(注意:X溶液为150?g含溴 3.2%的四氯化碳溶液)。
(1)试从如图所示装置中选用几种必要的装置,把它们连成一套装置,这些被选用的装置接口编号连接顺序是_________________。
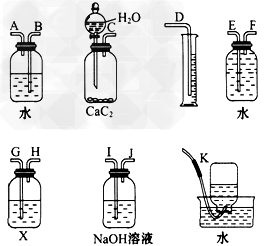
(2)实验室能否用启普发生器制乙炔?其原因是_________________。
(3)为了得到比较平稳的乙炔气流,常可用__________代替水。
(4)假设溴水与乙炔完全反应,生成C2H2Br4,用W?g的电石与水反应后,测得排入量筒内液体体积为V?mL(标准状况下),则电石纯度计算式为_______________。
3、简答题 某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去).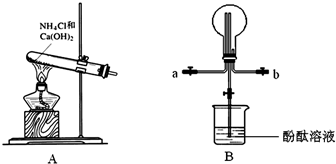
请回答:
(1)实验室制备氨气的化学方程式为______.
(2)收集氨气时,氨气的进气口应为______(填“a”或“b”).
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是______.
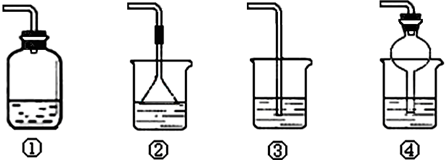
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是______(填序号).
4、实验题 在工业上,氯气是一种重要的化工原料;在实验室中,氯气和氯水是重要的化学试剂。
(1)资料显示,漂白粉在酸性(如硫酸)条件下可发生反应并生成氯气,有关反应的化学方程式为 Ca(ClO)2+CaCl2+2H2SO4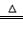 2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是__(填字母序号)。

②证明乙装置中FeCl2与Cl2发生了氧化还原反应的方法是___。
③丙装置中通入少量的Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强 于次氯酸,则丙中发生反应的化学方程式是___。
④该实验存在一个明显的缺陷,改进的方法是___
(2)某同学设计了一个实验方案以证明新制氯水中含有次氯酸。他所用的试剂如下:新制氯水、 0.5 mol.L-1的CaCl2溶液、品红溶液、CaCO3粉末,请你协助他完成实验方案。
步骤一:取5 mL 0.5 mol.L-1的CaCl2溶液于试管中,滴入3滴品红溶液,振荡,溶液不褪色。
步骤二:取5 mL新制氯水于试管中,___。
步骤三:____。 说明新制氯水中存在次氯酸的实验现象是___。设计步骤一的理由是___。
5、选择题 实验室制备下列气体,可以使用HNO3的是
A.H2
B.O2
C.NO2
D.NH3