1、填空题 如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.
试回答:
(1)A中发生的化学反应方程式为______.
(2)C、D、G中各装的药品:C______;D______;G______.
(3)E中的现象为______;反应方程式为______.
(4)写出G中反应的离子方程式______.
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因______.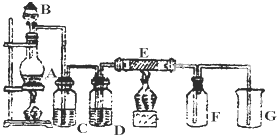
参考答案:(1)A中是实验室制氯气的发生装置,发生的化学反应方程式为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;
(2)实验制备氯气中含杂质气体氯化氢和水蒸气,通入E装置时需要除去杂质,所以通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;氯气有毒不能排到大气中,要进行尾气吸收,故答案为:饱和NaCl溶液;浓H2SO4 ;NaOH溶液;
(3)氯气和铁反应生成氯化铁产生棕褐色烟,剧烈反应放热,该反应为2Fe+3Cl2?点燃?.?2FeCl3 ,
故答案为:剧烈反应,产生棕黑色(棕褐色)的烟,放出大量热;2Fe+3Cl2?点燃?.?2FeCl3 ;
(4)G中反应是尾气吸收装置,氯气有毒需要用氢氧化钠溶液吸收,反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,氯气具有氧化性,二氧化硫具有还原性,二者1:1发生氧化还原反应生成硫酸和盐酸,反应的化学方程式为:Cl2+SO 2+2H2O═H2SO4+2HCl,故答案为:Cl2+SO 2+2H2O═H2SO4+2HCl.
本题解析:
本题难度:一般
2、选择题 实验室进行下列实验时,要用到温度计,且温度计水银球置于反应物液面以下的是( )
A.用蒸馏方法提纯水
B.乙醛的银镜反应
C.实验室制乙烯
D.实验室制取硝基苯
参考答案:C
本题解析:
本题难度:简单
3、选择题 实验室可用二氧化锰粉末与浓盐酸共热制取氯气,现只有浓盐酸,但没有二氧化锰,下列各种试剂中,不能替代二氧化锰制取氯气的是
[? ]
A.KMnO4
B.KClO3
C.CaCl2
D.Ca(ClO)2
参考答案:C
本题解析:
本题难度:简单
4、填空题 实验室用盐酸与二氧化锰混合加热制备Cl2,同时生成MnCl2和H2O,此反应的化学方程式为____, 其离子方程式为___,其中氧化剂为 ___,还原剂为___,可用___法收集Cl2。
参考答案:MnO2 +4HCl(浓) MnCl2+Cl2↑+2H2O ;MnO2+4H++ 2Cl-
MnCl2+Cl2↑+2H2O ;MnO2+4H++ 2Cl- Mn2++Cl2↑+2H2O ;
Mn2++Cl2↑+2H2O ;
MnO2 ;HCl ;向上排空气
本题解析:
本题难度:一般
5、简答题 实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:☆
Ⅰ.(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为______.
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是______.
A.溶解后的溶液未冷至室温就转入容量瓶中;
B.洗涤烧杯和玻棒的溶液未转入容量瓶中;
C.定容时眼睛俯视刻度线;
D.定容时眼睛仰视刻度线;
Ⅱ.(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
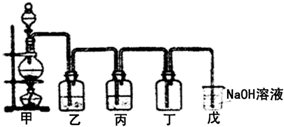
①写出甲中发生反应的离子方程式:______
②乙中盛的试剂是______;作用是______.
丙中盛的试剂是______.
(2)如果将过量二氧化锰与20mL该浓盐酸混合加热,充分反应后理论上可生成标况下的氯气的体积为______mL,而实际值明显少于理论值,其主要原因有:
①______;②______.
(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变______色,其离子方程式是______,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层是显______色,这种操作叫做______.
(4)若将制得的氯气制成饱和氯水,则实验室保存饱和氯水的方法是______.
参考答案:Ⅰ(1):浓盐酸的物质的量浓度c=1000×1.2×36.5%36.5mol/L=12.0mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓盐酸的体积,设浓盐酸的体积为xmL,所以xmL×12.0mol/L=250mL×0.1mol/L,解得:x≈2.1.
所需浓盐酸的体积为2.1mL.
故答案为:2.1mL.
(2)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以操作顺序是BCAFED.
故答案为:BCAFED.
(3)A.溶液具有热胀冷缩的性质,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,会导致溶液体积偏小,溶液浓度偏高;
B.洗涤液中含有溶质氯化氢,移入容量瓶中溶质氯化氢的物质的量减小,所配溶液浓度偏低;
C.定容时俯视刻度线,导致溶液体积减小,所配溶液浓度偏高;
D.定容时仰视刻度线,导致溶液体积增大,所配溶液浓度偏低.
故选:AC.
Ⅱ(1)实验室用第一个装置制备氯气,反应离子方程式为MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.因HCl和H2O的挥发,逸出的氯气中常混有少量氯化氢和水蒸气,若需收集纯净、干燥的氯气,就应进行净化.可依次通过盛有饱和食盐水和浓硫酸的洗气瓶,使氯化氢溶解于饱和食盐水(氯气在饱和食盐水中溶解度大大降低),水蒸气被浓硫酸吸收,经这样的净化处理,氯气就较纯净了,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置收集,
故答案为:①MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
②饱和NaCl溶液;?除去Cl2中混有的HCl气体.?浓H2SO4.
(2)MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O
? 4mol? 22.4L
0.02L×12.0mol/L=0.24mol? V
所以V=0.24mol4mol×22.4L=1.344L=1344?mL.
二氧化锰不能与稀盐酸反应,反应消耗氯化氢,浓盐酸易挥发出氯化氢都会导致盐酸浓度变小.
故答案为:1344?mL;?①部分浓盐酸挥发了;②随着反应的进行浓盐酸变稀,稀盐酸不能被氧化成氯气.
(3)氯气氧化性很强,将碘离子氧化为碘单质,反应离子方程式为Cl2+2I-=2Cl-+I2,碘水呈棕黄色.
碘在四氯化碳中溶解度远大于水中,四氯化碳密度比水大且不溶于水,所以溶液分层,下层为紫红色,该操作为萃取.
故答案为:棕黄;Cl2+2I-=2Cl-+I2;紫红;萃取.
(4)次氯酸见光受热易分解,饱和氯水应保存在细口棕色试剂瓶中,放置冷暗处.
故答案为:保存在细口棕色试剂瓶中,放置冷暗处.
本题解析:
本题难度:一般