1、填空题 正极材料为LiCoO2的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得
①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是________________
②共沉淀反应的化学方程式为____。
③高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后LiFePO4的导电性能外,还能________。
?(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为____。
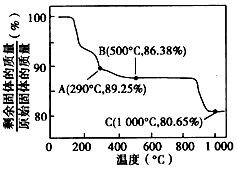
②Co(OH)2在空气中加热时,同体残留率随温度的变化如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为______(填化学式);在350~ 400℃ 范围内,剩余固体的成分为_________(填化学式)。
参考答案:(1)①Fe2+在碱性条件下更易被氧化(凡合理答案均可);②( NH4)2Fe(SO4)2+ LiOH十H3PO4=LiFePO4↓十 2NH4HSO4+H2O ;③与空气中O2反应,防止LiFePO4中的Fe2+被氧化(凡合理答案均可)
(2) ①8LiCoO2十Na2S2O3+11H2SO4=4Li2SO4+ 8CoSO4 +Na2SO4 +11H2O ;②CoO;Co2O3、Co3O4
本题解析:
本题难度:一般
2、选择题 铜锌原电池产生电流时,阳离子(?)
A.移向Zn极,阴离子移向Cu极
B.移向Cu极,阴离子移向Zn极
C.和阴离子都移向Zn极
D.和阴离子都移向Cu极
参考答案:B
本题解析:铜锌原电池,锌做负极,铜做正极,阳离子移向正极,即阳离子移向铜电极,阴离子移向锌电极。故选B。
本题难度:简单
3、选择题 Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是? ( )。

A.工作时正极发生还原反应
B.当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol
C.Al电极的反应式为Al-3e-+4OH-=AlO2—+2H2O
D.工作时电解液中的Na+透过隔膜移向Al电极
参考答案:D
本题解析:正极发生还原反应,A对;1.08 g银的物质的量为0.01 mol,B对;由总反应式可知,Al电极是负极,电极反应式为Al-3e-+4OH-=AlO2—+2H2O,C对;阳离子应移向正极,D错。
本题难度:一般
4、填空题 H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式 ,第二步的电离平衡常数表达式Ka2= 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
①I- ②Fe3+ ③Cu2+ ④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式: 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:

①第(
参考答案:
本题解析:
本题难度:困难
5、填空题 原电池是一种______装置.电子的流动方向是从______极到______极;电流方向是从______极到______极.电工操作中规定,不能把铜线和铝线拧在一起连接线路,这是因为在潮湿的空气中,铜与铝接触形成______,其中铝做______,很快被腐蚀.
参考答案:原电池是一种将化学能转化为电能的装置,在原电池中,电子的流动方向是从负极沿着导线流向正极,电流方向和电子流向相反,即从正极流向负极,铜、铝、潮湿的空气构成的原电池中,金属铝做负极,易被腐蚀.故答案为:将化学能转变为电能的;负;正;正;负;原电池;负极.
本题解析:
本题难度:一般