1、简答题 由铜片、锌片和200mL?稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36L(标准状况)气体时,H2SO4恰好完全消耗.求:
(1)反应中消耗的锌的质量是多少?(Zn:65)
(2)有多少个电子通过了导线?
(3)原稀H2SO4的物质的量浓度是多少?
参考答案:(1)由于锌比铜活泼,所以锌作负极,所以消耗的金属为锌.
锌失电子生成锌离子进入溶液,电极反应式为锌片:Zn-2e-=Zn 2+,铜片上氢离子得电子生成氢气,所以电极反应式为:铜片:2H++2e-=H2↑.
总反应:Zn+2H+=H2↑+Zn 2+
? 65g? 22.4L
? 9.75g? 3.36L
所以消耗金属的质量为9.75g.
故答案为9.75g.
(2)Zn+2H+=H2↑+Zn2+转移电子
? 22.4L? 2mol
? 3.36L? 0.3mol
所以转移电子的物质的量为0.3mol,即1.806×1023个.
故答案为1.806×1023个.
(3)根据氢原子守恒,H+全部由H2SO4提供,
所以n(H2)=n(H2SO4)=0.15mol
c(H2SO4)=0.15mol?0.2L=0.75mol/L
故答案为0.75mol/L.
本题解析:
本题难度:一般
2、填空题 海水中蕴藏着丰富的资源.海水综合利用的流程图如图1.
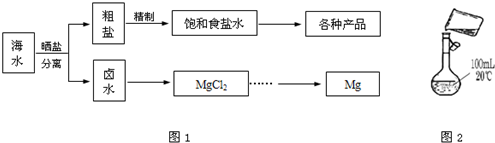
(1)为检验精盐纯度,需配制250mL?0.2mol/L?NaCl(精盐)溶液,图2是该同学转移溶液的示意图,图中有两点错误请指出:______
(2)用NaCl做原料可以得到多种产品.
实验室用惰性电极电解100mL?0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况,假设气体物质全部从溶液中逸出),则所得溶液的pH为______(忽略反应前后溶液的体积变化).
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图3所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
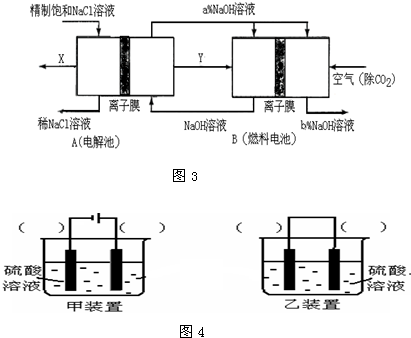
①图中X、Y分别是______、______(填化学式),②写出燃料电池B中正极发生的电极反应______;
(4)图4欲实现Cu+H2SO4═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).
参考答案:(1)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,右图该同学在转移溶液时没有用玻璃棒引流,配制250mL的溶液要采用250mL的容量瓶,故答案为:未用玻璃棒引流;未采用250?mL容量瓶;
(2)因电解饱和食盐水的方程式:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑,当产生的H2的体积为112mL即0.005mol时,生成氢氧化钠的物质的量为0.01mol,所以溶液中NaOH的物质的量浓度=0.01mol0.1L═0.1mol/L,所以氢离子的浓度为1×10?-140.1=1×10-13mol/L,PH=13,故答案为:13;
(3)①电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程,阴极是氢离子得电子生成氢气的过程,故答案为:Cl2,H2;
②氢氧燃料电池的电解质是碱时,电池总反应式均可表示为:2H2+O2=2H2O,其正极反应表示为:O2+2H2O+4e-=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(4)Cu和H2SO4之间的反应是非自发的,需要电解池实现,金属铜作阳极,阴极是导体即可,电解质为硫酸,即:
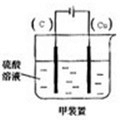
,故答案为:
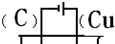
.
本题解析:
本题难度:一般
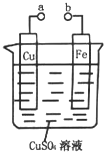
3、选择题 某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动
D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色