1、选择题 下列装置中能够形成原电池的是(?)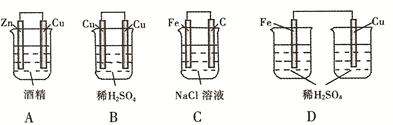
参考答案:C
本题解析:酒精为有机化合物,其不能作为电解质溶液,不能构成原电池,选项A错误;电解质溶液为稀H2SO4 ,但正负极都为Cu,不能有效构成原电池,选项B错误;选项D错误,缺少盐桥,无法有效组成原电池,故选C。
点评:该题是基础性的试题,也是高考中的常见考点之一;该题的关键是明确原电池的工作原理,然后结合相关知识灵活运用、分析、判断即可。考生平时应当多注重基础的延伸,侧重能力的训练。
本题难度:简单
2、选择题 有关如下图所示原电池的叙述正确的是(盐桥中装有含琼胶的KCl饱和溶液)
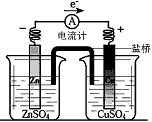
[? ]
A.铜片上有气泡逸出
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.反应前后铜片质量不改变
参考答案:C
本题解析:
本题难度:一般
3、简答题 2FeCl3+Cu=2FeCl2+CuCl2
根据此反应选择适宜的材料和试剂设计一个原电池:
(1)负极材料是______,(2)正极材料是______,(3)电解质溶液是______;
(4)写出正极的电极反应式______,(5)负极发生______反应.
参考答案:(1)该电池反应中,铜失电子发生氧化反应,选发生氧化反应的金属单质作负极,所以选铜作负极.
故答案为:铜片;
(2)选不如负极活泼的金属或导电的非金属作正极,可用石墨作正极.
故答案为:石墨;
(3)选发生还原反应的电解质溶液作原电池的电解质溶液,该反应中氯化铁得电子发生还原反应,所以选氯化铁溶液作电解质溶液.
故答案为:FeCl3溶液;
(4)正极上三价铁离子得电子发生还原反应,电极反应式为Fe3++e-═Fe2+.
故答案为:Fe3++e-═Fe2+;
(5)负极上失电子发生氧化反应.
故答案为:氧化.
本题解析:
本题难度:一般
4、选择题 下列事实不能用原电池原理解释的是( )
A.将镁粉、铁粉和食盐一块加到水中迅速反应放热
B.铁被钝化处理后不易腐蚀
C.纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快
D.镀层破损后,镀锌铁比镀锡铁更耐用
参考答案:A、将镁粉、铁粉和食盐一块加到水中,构成原电池装置,金属镁是负极,镁和水的反应是放热反应,形成原电池可以加快化学反应速率,能用原电池原理解释,故A错误;
B、铁被钝化后,在金属表面上会形成一层致密的金属氧化膜,保护内部金属不被腐蚀,不能用原电池原理解释,故B正确;
C、纯锌与稀硫酸反应时,滴入少量CuSO4溶液后,金属锌可以和硫酸铜反应置换出铜,Zn、Cu、硫酸会形成原电此装置,Zn为负极,使得Zn和硫酸的反应速率加快,能用原电池原理解释,故C错误;
D、镀层破损后,镀锌铁和潮湿空气形成的原电池中,金属Zn为负极,Fe为正极,Fe被保护,镀锡铁和潮湿空气形成的原电池中,金属Fe为负极,Sn为正极,Fe被腐蚀速率加快,镀锌铁比镀锡铁更耐用,能用原电池原理解释,故D错误.
故选B.
本题解析:
本题难度:简单
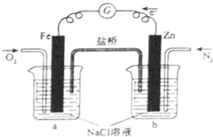
5、选择题 根据图,下列判断中正确的是( )
A.烧杯a中的溶液pH升高
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-═H2
D.烧杯b中发生的反应为2Cl--2e-═Cl2