1、选择题 下列说法中不正确的是( )
A.对于吸热反应,反应物所具有的总能量低于生成物所具有的总能量
B.放热反应在常温条件下不一定能发生
C.1mol硫酸跟足量氢氧化钠发生中和反应放出的热叫做中和热
D.在?101?kPa?时,1?mol?纯物质完全燃烧生成最稳定的氧化物时所放出的热量就叫做该物质的燃烧热
参考答案:A、对于吸热反应,反应物所具有的总能量低于生成物所具有的总能量,故A正确;
B、放热反应在常温条件下不一定能发生,如铝热反应必须在高温下发生,故B正确;
C、0.5mol硫酸跟足量氢氧化钠发生中和反应生成1mol水所放出的热叫做中和热,故C错误;
D、燃烧热是在101kPa?时,1mol?纯物质完全燃烧生成最稳定的氧化物时所放出的热量,故D正确.
故选C.
本题解析:
本题难度:简单
2、选择题 下列反应属于氧化还原反应,且生成物的总能量高于反应物的总能量的是(?)
A.铝热反应
B.铝与盐酸反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体反应
D.灼热的炭与CO2反应
参考答案:D
本题解析:生成物的总能量高于反应物的总能量,说明反应是吸热反应,A、B是放热反应,C不是氧化还原反应,因此答案选D。
点评:一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应,据此可以进行判断。
本题难度:一般
3、选择题 下列说法正确的是(?)
A.凡是放热反应的发生都不需要加热
B.凡是需要加热才能发生的反应都是吸热反应
C.凡是伴有能量变化的物质变化都一定是化学变化
D.物质发生化学反应都伴随着能量变化
参考答案:D
本题解析:反应条件与反应是放热反应或吸热反应无关系,选项AB不正确;物理变化过程中也会伴随能量变化,C不正确,答案选D。
点评:该题是基础性试题的考查,也是高考中的常见题型,试题基础性强,侧重对学生基础知识的巩固和训练。有利于培养学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
4、填空题 (12分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
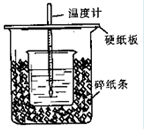
(1)从实验装置上看,图中尚缺少的一种玻璃用品是?。
(2)烧杯间填满碎纸条的作用是?。
(3)大烧杯上如不盖硬纸板,求得的中和热数值?(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量?(填“相等、不相等”),所求中和热?(填“相等、不相等”),简述理由?。
参考答案:(1)环形玻璃搅拌棒?(2)减少实验过程中的热量损失?(3)偏小
(4)不相等;相等;因为中和热是指酸跟碱发生中和反应生成1mol H2O所放出的热量,与酸碱的用量无关
本题解析:考查中和热的测定实验。
(1)在反应中为了使反应进行的更充分,同时也为了使溶液混合均匀,需要搅拌。因此还缺少环形玻璃搅拌棒。
(2)该实验应该离开你减少热量的损失,所以烧杯间填满碎纸条的作用是减少实验过程中的热量损失。
(3)大烧杯上如不盖硬纸板,则会导致热量损失,使测定结果偏小。
(4)如果改变酸碱的物质的量,则反应中放出的热量是不相同的,但中和热是不变的,因为中和热是指酸跟碱发生中和反应生成1mol H2O所放出的热量,与酸碱的用量无关。
本题难度:一般
5、填空题 以节能减排为基础的低碳经济已成为实现人类可持续发展的重要课题。
(1)控制和治理CO2是解决温室效应的有效途径,其中一种途径是将CO2转化成有机物实现碳循环。如2CO2(g)+2H2O(1)?C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)?C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由C2H5OH(1)转化为C2H4(g)和H2O(1)的热化学方程式为?。
(2)为探究反应6H2(g)+2CO2(g)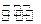 CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
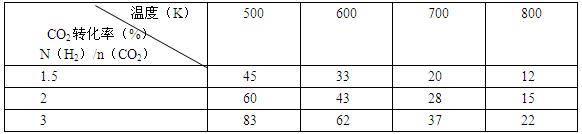
根据表中实验数据分析:
①该反应的正反应为?(填“吸热”或“放热”)反应。
②为提高CO2的平衡转化率,可采取的措施有?(写出一条即可)。
(3)一定条件下,将3 mol H2和1mol CO2气态混合物充入2L密闭容器中,发生如下反应:3H2(g)+CO2(g)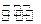 CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是?。
CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是?。
A.该反应的平衡常数表达式为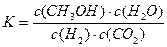
B.CO2的平衡转化率为40%
C.2min内H2的平均反应速率为0.3mol/(L·min)
D.该反应达到平衡状态的标志是混合气体的密度不发生改变