1、填空题 Al和Ga及N和As分别是同主族的元素,请回答下列问题:
(1)砷化镓是一种半导体材料,其化学式为?。
(2)写出As原子处于基态时的核外电子排布式?。
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与?个氮原子相连,氮化铝晶体属于?晶体。
(4)NH3是氮的氢化物,中心原子的杂化方式是?,存在化学键的类型是?,NH3的沸点比AsH3高的原因是?。
参考答案:
本题解析:略
本题难度:一般
2、选择题 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是( )
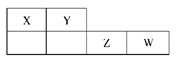
A.氢化物稳定性:X>Y
B.最高价氧化物对应的水化物的酸性:W>Y
C.4种元素的单质中,W单质的熔、沸点最高
D.干燥的W单质具有漂白性
参考答案:B
本题解析:根据题意可知:X是B;Y是C;Z是P,W是S。A.由于非金属性Y>X,元素的非金属性越强,其氢化物的稳定性就越强,所以氢化物稳定性:Y >X,错误;B.元素的非金属性:W>Y,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以酸性:W>Y,正确;C.4种元素的单质中,C元素的单质金刚石是原子晶体,单质的熔、沸点最高,错误;D.S单质没有漂白性,错误。
本题难度:一般
3、选择题 下列分子中,所有原子的最外层均为8电子结构的是 ?(?)
A.BeCl2
B.NCl3
C.H2S
D.PCl5
参考答案:B
本题解析:只要微粒中元素化合价的绝对值和该元素最外层电子数之和满足8,则该元素的原子就满足8电子稳定结构,据此可知B正确,A中Be元素,C中H元素,D中P元素均不能满足8电子稳定结构,答案选B。
点评:该题的关键是明确8电子稳定结构的判断依据,然后根据元素的化合价判断即可,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
4、计算题 某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25%。
(1)计算R的相对原子质量( 3分);
3分);
(2)写出R最高价氧化物对应的水化物的化学式(1分),并设计一个实验方案证明其酸性比盐酸弱。(3分)
参考答案:(1)12(3分);
(2)H2CO 3(1分),实验方案:往石灰石滴加稀盐酸,产生大量气泡,该无色气体能使澄
3(1分),实验方案:往石灰石滴加稀盐酸,产生大量气泡,该无色气体能使澄 清石灰水变浑浊,则为二氧化碳气体。根据强酸制弱酸的原理可得碳酸的酸性比盐酸弱。(3分)
清石灰水变浑浊,则为二氧化碳气体。根据强酸制弱酸的原理可得碳酸的酸性比盐酸弱。(3分)
本题解析:略
本题难度:一般
5、实验题 (13分) 现有短周期元素X形成的单质A与NaOH溶液反应,
有如下 转化关系:
转化关系: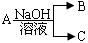 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为?,实验室制备A的化学方程式为?;
(2)若常温常压下,A为非金属固态单质 ,且其在电子工业中有着重要的用途,则工业制取A化学方程式为?;
,且其在电子工业中有着重要的用途,则工业制取A化学方程式为?;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为?
?;其最高氧化物与NaOH溶液反应的离子方程式为?;
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:
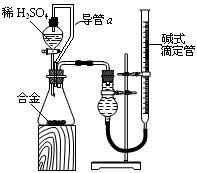
①装置中导管a的作用是? ?;
?;
②实验中准确测得4个数据:实验前该合金的质量m1 g,实验后残留固体的质量m2 g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL;则通常状况时气体摩尔体积Vm=____________L·moL-1。
参考答案:(13分) (1)Cl2+2OH-=Cl-+ClO-+H2 O MnO2+4HCl= MnCl2+ Cl2+2H2O
O MnO2+4HCl= MnCl2+ Cl2+2H2O
(2 )2C+SiO2="2CO+Si?" (3)2Al+2OH-+2H2O=2AlO2-+3H2
)2C+SiO2="2CO+Si?" (3)2Al+2OH-+2H2O=2AlO2-+3H2
Al2O3+2OH-=2AlO2-+H2O? (4)连通压强,便于液体流出。 18(V1-V2)10-3/(m1-m2)
本题解析:略
本题难度:简单