1、填空题 甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:
①?CH4(g)?+?H2O?(g)?=?CO?(g)+3H2?(g)?△H1=+206.2kJ·mol-1
②?CH4(g)+?1/2O2(g)=CO(g)+2H2(g)?△H2=-35.4?kJ·mol-1
③?CH4(g)?+?2H2O?(g)?=CO2(g)?+4H2(g)?△H3=+165.0?kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为__________________。 ?
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为________(填序号),其原因是__________________________。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:Cu(NH3)2Ac?+?CO?+?NH3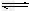 [Cu(NH3)3]Ac·CO?△H<0 Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是______________。
[Cu(NH3)3]Ac·CO?△H<0 Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是______________。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
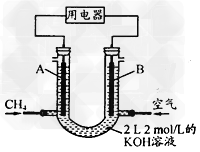
①?0<V≤44.8?L时,电池总反应方程式为___________________; ?
②?44.8?LV≤89.6?L时,负极电极反应为_____________; ?
③?V=67.2?L时,溶液中离子浓度大小关系为__________________。
参考答案:(1)CH4(g)+CO2(g)?=2CO?(g)+2H2(g)?△H=+247.4?kJ·mol-1
(2)②;选择CH4不完全燃烧制合成气时,放出热量,同时得到的CO、H2物质的量之比为1:2,能恰好完全反应合成甲醇
(3)低温、高压
(4)①CH4?+?2O2?+?2KOH?=K2CO3?+?3H2O;②CH4-8e-+?9CO32-+3H2O=10HCO3-?;③c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
本题解析:
本题难度:一般
2、填空题 (6分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g)ΔH="+206.0" kJ·mol-1
CO(g)+3H2(g)ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g) CH3OH(g)ΔH="-129.0" kJ·mol-1
CH3OH(g)ΔH="-129.0" kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 _____________。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+ 氧化成Co3+,然后以Co3+ 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
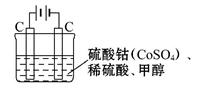
①写出阳极电极反应式 _______ 。
②写出Co3+除去甲醇的离子方程式 。
参考答案:(6分) (1) CH4(g)+H2O(g) CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1
CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1
(2)①Co2+ — e-  Co3+ ②6Co3++CH3OH+H2O
Co3+ ②6Co3++CH3OH+H2O CO2↑+6Co2++6H+
CO2↑+6Co2++6H+
本题解析:(1)根据盖斯定律,I+II可得所求的热化学方程式,所以CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为CH4(g)+H2O(g) CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1;
CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1;
(2)①阳极发生氧化反应,则Co2+ 被氧化成Co3+,电极反应式为Co2+ — e-  Co3+;
Co3+;
②Co3+ 作氧化剂把水中的甲醇氧化成CO2而净化,本身又被还原为Co2+,所以Co3+除去甲醇的离子方程式是6Co3++CH3OH+H2O CO2↑+6Co2++6H+。
CO2↑+6Co2++6H+。
考点:考查离子方程式的书写,盖斯定律的应用
本题难度:一般
3、填空题 如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极。
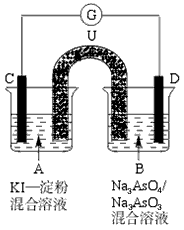
(1)As(砷)位于元素周期表中第4周期ⅤA族,则Na3AsO4溶液的pH________ (填“>”“<”或“=”)7。
(2)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是_________________________,D电极上的电极反应式为________________。
(3)一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时整套实验装置的总的离子方程式为______________________。
(4)再过一段时间后,G的指针逐渐归零,此时实验装置中的化学反应已经达到化学平衡状态,该反应的化学平衡常数的表达式为:K=___________________。
参考答案:(1)>
(2)无色溶液变成蓝色;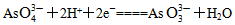
(3)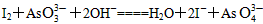
(4)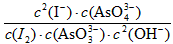
本题解析:
本题难度:一般
4、选择题 如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是

A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
参考答案:B
本题解析:A、K1闭合构成原电池,铁棒是负极,铁失去电子,铁棒上发生的反应为Fe+2e-→Fe2+,A不正确;B、K1闭合构成原电池,铁棒是负极,铁失去电子,石墨棒是正极,溶液中的氧气得到电子转化为OH-,石墨棒周围溶液pH逐渐升高,B正确;C、K2闭合构成电解池,铁棒与电源的负极相连,作阴极不会被腐蚀,属于外加电流的阴极保护法,C不正确;D、K2闭合构成电解池,铁棒与电源的负极相连,作阴极溶液中的氢离子放电生成氢气。石墨棒是阳极,溶液中的氯离子放电生成氯气,电路中通过0.002NA个电子时,两极均产生0.001mol气体,共计是0.002mol气体,D不正确,答案选B。
本题难度:一般
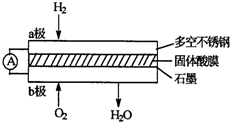
5、选择题 某固体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-═4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极