1、实验题 张明同学在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究。
[实验一]探究浓硫酸的氧化性。
将实验室常用的药品放入如图所示的实验装置后,加热装置甲。(夹持和加热装置省略)

(1)该装置在设计上存在明显的缺陷,请指出:_____________________。
(2)写出装置甲中反应的化学方程式:______________________。
(3)装置乙中的试剂是_____________。
[实验二]探究某硫酸亚铁盐固体是否变质。
(4)请你帮助张明同学完成如下实验方案:

[实验三]用KHSO4制取H2O2并测其质量分数。查阅资料得知,工业上电解KHSO4饱和溶液制取H2O2的示意图如下:

张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑)
①取5. 00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中,加水稀释,再加稀硫酸酸化;
②用0. 100 0 mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19. 98 mL、20.02 mL。
回答下列问题:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为__________________。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消 失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是________________。
(7)原H2O2溶液中溶质的质量分数为_________。
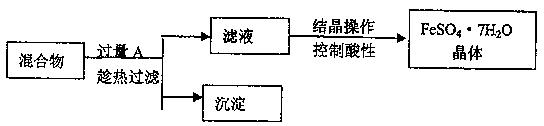
2、填空题 某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
请根据题目要求回答下列问题:
(1)A的化学式为?,上述操作过程中用到的玻璃仪器有:①烧杯、②③玻璃棒、③酒精灯、④温度计、⑤?。
(2)趁热过滤的目的是?。
(3)结晶操作过程中应控制滤液酸性的原因是____?
(4)已知硫酸亚铁铵[(NH4)2Fe (SO4)2]比硫酸亚铁稳定,用在分析化学中。硫酸亚铁铵可用硫酸铵和硫酸亚铁反应制得。实验室利用硫酸亚铁铵溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出硫酸亚铁铵溶液与草酸溶液反应的离子方程式____?。
(5)草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
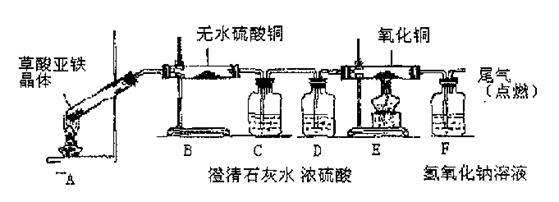
①该装置中最不合理的部分?(填字母),原因是?。
②改用正确装置实验开始后,B处变蓝,说明草酸亚 铁晶体中有?;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生?(填化学式)。
铁晶体中有?;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生?(填化学式)。
3、填空题 为测定空气中CO2含量,做下述实验。
配0.1mol/L的标准盐酸和0.01mol/L的标准盐酸
| →
| 用0.1mol/L的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60 mL
| →
| 用Ba(OH)2溶液吸收空气中的CO2
| →
| 过
滤
| →
| 取滤液20mL,用0.01mol/L的盐酸滴定用去盐酸34.8mL
|
(1)为配置标准溶液,请选取必需的一组仪器?。
①托盘天平②容量瓶③滴定管④量筒⑤烧杯⑥胶头滴管⑦玻璃棒
A.①②⑤⑥
B.②④⑤⑥⑦
C.②①⑥⑦
D.②④⑤⑥