1、实验题 下图是有关二氧化硫性质的实验装置图,试回答下列问题。

(1)A、C装置中发生的现象依次是__________、____________;
(2)二氧化硫具有:①漂白性;②酸性氧化物性质;③还原性;④氧化性。在图中几个装置中对应表现出的性质是(填序号)A中___________,B中___________,C中___________,D中____________;
(3)实验完毕后,将B中溶液取少量于试管中,加热,现象是___________,原因是_________________;
(4)实验完毕后,取少量D中溶液于试管中,加入BaCl2溶液和稀盐酸,现象是__________________;
(5)E中发生反应的离子方程式是__________________。
参考答案:(1)溶液变红色;溶液变浑浊或产生淡黄色沉淀
(2)②;①;④;③
(3)无色溶液变为红色;SO2与品红生成了不稳定的无色化合物,该化合物受热易分解,产生的SO2挥 发,品红又恢复原来红色
(4)产生白色沉淀
(5)SO2+2OH-=SO32-+H2O
本题解析:
本题难度:一般
2、填空题 实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。化学小组主要选用了下列药品和仪器进行实验(铁架台等固定仪器未画出)。按气流由左向右的方向,仪器连接顺序是 。回答以下问题:
。回答以下问题:

(1)A中加入硫酸溶液的仪器名称是:?。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,排除装置中原有的空气。加酸后A装置再次鼓入空气的作用是? ?。
(3)E装置的作用是? ?。
(4)实验中,要确保实验中C瓶溶液不褪色,若C瓶中溶液褪色,则测定结果可能会偏? ?(填“高”或“低”)。
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为? ?。
(6)从定量测定的准确性考虑,该套装置还应作进一步的改进是?。
参考答案:(12分)(1)分液漏斗(2分)
(2)将生成的气体全部送入后续装置(使反应产生的SO2和CO2被完全吸收)(2分)
(3)除去SO2,以防止SO2对测定结果的影响(2分)
(4)高? (共2分)?(5)60.3%(2分)
(6)在B之后再接一个阻止空气中水蒸气和二氧化碳进入B的装置。(2分)
本题解析:(1)根据仪器的构造特点可知,A中加入硫酸溶液的仪器名称是分液漏斗。
(2)加酸后生成CO2和SO2气体,所以加酸后A装置再次鼓入空气的作用是将生成的气体全部送入后续装置(使反应产生的SO2和CO2被完全吸收)。
(3)由于SO2也能碱石灰吸收,会干扰CO2的测定,所以高锰酸钾溶液的作用是除去SO2,以防止SO2对测定结果的影响。
(4)若C瓶中溶液褪色,说明SO没有完全被除尽,也被碱石灰吸收,则测定结果可能会偏高。
(5)碱石灰增重4.4g,则反应中生成的CO2的质量就是4.4g,物质的量是0.1mol。则根据碳原子守恒可知,碳酸氢铵的物质的量也是0.1mol,质量是7.9g,所以混合物中NH4HCO3的质量分数为 。
。
(6)由于空气中也含有水蒸气和CO2,也能被碱石灰吸收,所以从定量测定的准确性考虑,该套装置还应作进一步的改进是在B之后再接一个阻止空气中水蒸气和二氧化碳进入B的装置。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,难易适中,在注重对学生基础知识检验与巩固的同时,侧重对学生能力的培养和实验能力的训练与指导。有助于培养学生规范、严谨的实验设计能力,提高学生的综合实验能力,提升学生的学科素养。该类试题重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
3、实验题 新型材料纳米α-Fe粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,α-Fe粉与蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。
(1)甲同学用下图所示装置进行α-Fe粉与水蒸气的反应。

证明实验中有氢气产生的现象是______________________。
(2)乙同学用下图所示装置进行α-Fe粉与水蒸气的反应并验证产物。
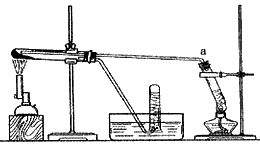
①试管a中的物质是____________。
②乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验

实验现象不能确定是否存在Fe3O4,主要原因是________________(用离子方程式表示)
③乙同学称取5.60gFe粉,用上图装置反应一段时候后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3的物质的量,最终确定产物的成分。若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为
_________mol。
参考答案:(1)有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸
(2)①水;②溶液没有出现血红色;2Fe3++Fe=3Fe2+;③0.08
本题解析:
本题难度:困难
4、选择题 下列根据实验操作和现象得出的结论正确的是
选项
| 实验操作
| 实验现象
| 结论
|
A
| 某钠盐溶液滴入AgNO3溶液
| 有白色沉淀
| 该钠盐不一定是NaCl
|
B
| 浓硫酸与NaCl固体混合加热
| 有气体产生
| 硫酸的酸性比HCl强
|
C
| 某无色气体通入溴水中
| 溴水褪色
| 该气体一定是C2H4
|
D
| 向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液
| 出现黄色沉淀
(PbI2)
| KSP(PbI2)<KSP(PbCl2)
参考答案:AD
本题解析:A、与硝酸银溶液反应产生白色沉淀的不一定氯化钠,也可能是硫酸银或碳酸盐,A正确;B、浓硫酸与固体氯化钠反应制备氯化氢利用的是浓硫酸的难挥发性,与酸性强弱无关系,B不正确;C、能使溴水褪色的无色气体不一定乙烯,也可能是乙炔或二氧化硫等,C不正确;D、向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液出现黄色沉淀,根据沉淀容易转化为更难溶的物质可知KSP(PbI2)<KSP(PbCl2),D正确,答案选AD。
本题难度:一般
5、实验题 根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar (Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4Cl与Ca(OH)2的量足以产生使CuO完全还原的氨气):

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为____________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→__________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①CuO未完全起反应
② CuO不干燥
③CuO中混有不反应的杂质
④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定______和_____,或_____和______达到实验目的。
参考答案:(1)2NH3+3CuO 3Cu+3H2O+N2↑ 3Cu+3H2O+N2↑
(2)a→e→b→e→e
(3)18a/b-16
(4) ①③
(5) m(CuO)和m(Cu); m(Cu)和m(H2O)
本题解析:
本题难度:一般
|