1、实验题 下图是有关二氧化硫性质的实验装置图,试回答下列问题。

(1)A、C装置中发生的现象依次是__________、____________;
(2)二氧化硫具有:①漂白性;②酸性氧化物性质;③还原性;④氧化性。在图中几个装置中对应表现出的性质是(填序号)A中___________,B中___________,C中___________,D中____________;
(3)实验完毕后,将B中溶液取少量于试管中,加热,现象是___________,原因是_________________;
(4)实验完毕后,取少量D中溶液于试管中,加入BaCl2溶液和稀盐酸,现象是__________________;
(5)E中发生反应的离子方程式是__________________。
2、填空题 实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。化学小组主要选用了下列药品和仪器进行实验(铁架台等固定仪器未画出)。按气流由左向右的方向,仪器连接顺序是 。回答以下问题:
。回答以下问题:

(1)A中加入硫酸溶液的仪器名称是:?。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,排除装置中原有的空气。加酸后A装置再次鼓入空气的作用是? ?。
(3)E装置的作用是? ?。
(4)实验中,要确保实验中C瓶溶液不褪色,若C瓶中溶液褪色,则测定结果可能会偏? ?(填“高”或“低”)。
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为? ?。
(6)从定量测定的准确性考虑,该套装置还应作进一步的改进是?。
3、实验题 新型材料纳米α-Fe粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,α-Fe粉与蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。
(1)甲同学用下图所示装置进行α-Fe粉与水蒸气的反应。

证明实验中有氢气产生的现象是______________________。
(2)乙同学用下图所示装置进行α-Fe粉与水蒸气的反应并验证产物。
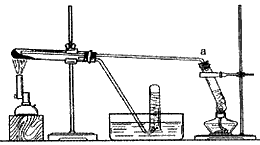
①试管a中的物质是____________。
②乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验

实验现象不能确定是否存在Fe3O4,主要原因是________________(用离子方程式表示)
③乙同学称取5.60gFe粉,用上图装置反应一段时候后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3的物质的量,最终确定产物的成分。若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为
_________mol。
4、选择题 下列根据实验操作和现象得出的结论正确的是
选项
| 实验操作
| 实验现象
| 结论
|
A
| 某钠盐溶液滴入AgNO3溶液
| 有白色沉淀
| 该钠盐不一定是NaCl
|
B
| 浓硫酸与NaCl固体混合加热
| 有气体产生
| 硫酸的酸性比HCl强
|
C
| 某无色气体通入溴水中
| 溴水褪色
| 该气体一定是C2H4
|
D
| 向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液
| 出现黄色沉淀
(PbI2)
| KSP(PbI2)<KSP(PbCl2)
5、实验题 根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar (Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4Cl与Ca(OH)2的量足以产生使CuO完全还原的氨气):

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为____________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→__________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①CuO未完全起反应
② CuO不干燥
③CuO中混有不反应的杂质
④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定______和_____,或_____和______达到实验目的。
|