1、选择题 一些不法商人在面粉生产中添加过氧化钙(CaO2)等添加剂对食品进行增白。下列关于过氧化钙(CaO2)的叙述正确的是
A.CaO2中阴、阳离子的个数比为1:1
B.CaO2对面粉增白原理与SO2漂白原理相似
C.CaO2和水反应时,每产生1 molO2转移电子4 mol
D.CaO2放入NaHCO3溶液中,会放出二氧化碳,并产生白色浑浊
参考答案:A
本题解析:A.CaO2中阴、阳离子分别是Ca2+和O22-的个数比为1:1,正确;B.CaO2对面粉增白原理是利用其的强氧化性,SO2漂白原理是能与有色物质化合生成了无色物质,错误;C.CaO2和水反应时,每产生1 molO2转移电子是2 mol,错误;D.CaO2放入NaHCO3溶液中,先与水反应生成氢氧化钙和氧气,然后氢氧化钙和NaHCO3反应生成白色沉淀,不会放出二氧化碳气体,要产生二氧化碳气体必须要在酸性条件下的,错误;
本题难度:一般
2、选择题 某温度下,将氯气通入NaOH溶液中,反应得到NaC1、Na C1O、Na C1O3的混合液,经测定C1O-与C1O3-的浓度之比为3 :1,则氯气与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.1 :2
B.2 :1
C.1 :1
D.8 :3
参考答案:B
本题解析:考查在氧化还原反应中的化合价升降守恒:Cl2 + NaOH=" NaC1+3Na" C1O+1Na C1O3+H2O
由产物中氯的化合价可知:四个氯原子共升高3×1+1×5=8,故必然同时生成8个氯原子从0价降至—1价;所以被还原的氯元素与被氧化的氯元素的物质的量之比为2:1
本题难度:一般
3、选择题 将a g二氧化锰粉末加入b mol·L-1的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是(?)
A.可以收集到氯气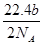 L
L
B.反应后溶液中的Cl-数目为2aNA/87
C.NA可表示为
D.反应后溶液中的H+数目为(bc-2d)
参考答案:C
本题解析:A项,V(Cl2)=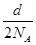 ×22.4 L,A错;B项,(bcNA-d)个,错误;C项,
×22.4 L,A错;B项,(bcNA-d)个,错误;C项,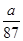 ×2×NA=d,NA=
×2×NA=d,NA= ,正确;D项,考虑到浓盐酸的挥发,无法计算溶液中H+的数目。
,正确;D项,考虑到浓盐酸的挥发,无法计算溶液中H+的数目。
本题难度:一般
4、填空题 (2分)配平方程式:? Zn +? HNO3— Zn(NO3)2 +? N2 +? H2O
参考答案: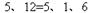
本题解析:略
本题难度:一般
5、填空题 (Ⅰ)(6分)配平下列氧化还原反应方程 式:
式:
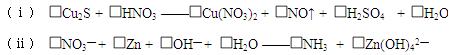
(Ⅱ)(10分)某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
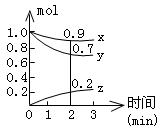
(1)计算反应开始2min内的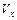 = ,
= , 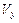 = ,
= , = ,
= ,
(2)容器内的反应物是 。
(3)写出该反应的化学方程式 。
参考答案:(6分,每题3分)(1)(
本题解析:
本题难度:一般