1、填空题 镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s)?△H3
则△H3 =?kJ·mol-1。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4Cl·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为?;电解熔融氯化镁,阴极的电极反应式为?。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为?。
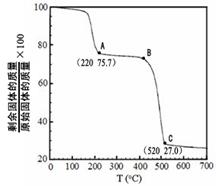
(4)工业上用MgC2O4·2H2O热分解制超细MgO,其热分解曲线如图。
图中隔绝空气条件下B→C发生反应的化学方程式为?。
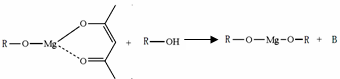
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为: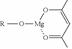 ,它可发生如下反应:
,它可发生如下反应:
ROH与B的核磁共振氢谱如下图:
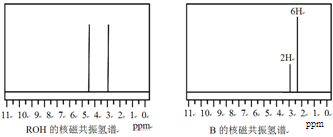
ROH由C、H、O、F四种元素组成的含氟有机物,分子中只有1个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为?; B的结构简式为?。
2、计算题 已知:化学反应3Ag+ 4HNO3 (稀)= 3AgNO3+ NO↑+ 2H2O?
(1)该反应的离子方程式为:_________________________________? ____
(2)当有32.4克银溶解时,反应生成的NO在标况下的体积是多少?
(3)当有0.2mol银溶解时,有多少克HNO3被还原?
3、选择题 某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液。若Cl2与KOH溶液反应时,被还原与被氧化的氯元素物质的量之比是11︰3,则混合液中ClO-与ClO3-的物质的量之比是(?)
A.1︰1
B.1︰2
C.1︰3
D.2︰1
4、选择题 铁氧磁体法处理Cr2O72-的废水的原理可概述为:向Cr2O72-的酸性废水中加人 FeSO4·7H2O ,将Cr2O72-还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、 罗马数字表示元素的价态)的沉淀。处理含 1 mol Cr2O72-的废水至少需要加人amol FeSO4·7H2O?。下列结论正确的是
罗马数字表示元素的价态)的沉淀。处理含 1 mol Cr2O72-的废水至少需要加人amol FeSO4·7H2O?。下列结论正确的是
A.x= 0.5 , a=" 8"
B.x = 0.5 , a="10"
C.x = 1.5 , a=" 8"
D.x = 1.5 , a= 10
5、填空题 (本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是 ;
24.碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是 ;液溴的保存通常采取的方法是 。
26.通过比较___________或________________可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体:
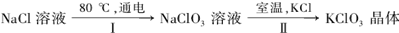
①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O 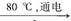 □NaClO3+ □
□NaClO3+ □
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________。