| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《弱电解质电离平衡》试题预测(2019年最新版)(四)
参考答案: 本题解析: 本题难度:一般 3、选择题 液氨溶解金属钠后成为蓝色的导电性很强的溶液,其颜色被认为是电子的氨合[e-(NH3)n]引起的。若放置 后,蓝色逐渐褪去,蒸发褪色后的溶液得到白色氨基钠( NaNH2),反应的化学方程式为:2Na+2NH3== 2NaNH2+H2↑。下列说法中不正确的是 参考答案:C 本题解析: 本题难度:一般 4、选择题 关于pH相同的醋酸和盐酸,下列叙述正确的是 参考答案:C 本题解析:盐酸是强酸,醋酸是弱酸,醋酸溶液中存在电离平衡,加水稀释能促进弱电解质电离,pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,不同的酸和相同金属反应,生成氢气的速率与溶液中离子浓度成正比;A、pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,促进醋酸的电离,结果两溶液的pH仍然相同,所以醋酸稀释的倍数大,即m>n,错误;B、pH相同的醋酸和盐酸氢离子浓度相同,所以取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸等于醋酸,错误;C、pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸消耗NaOH的物质的量比盐酸多,正确;D、pH相同的醋酸和盐酸氢离子浓度相同,则氢氧根离子浓度也相同,根据电荷守恒知c(CH3COO-)=c(Cl-),错误。 本题难度:一般 5、简答题 二元弱酸是分步电离的,25时碳酸和草酸的Ka如表:
A.0.1mol?L-1的Na2C2O4溶液B.0.1mol?L-1的NaHC2O4溶液 C.0.1mol?L-1的Na2CO3溶液D.0.1mol的NaHCO3溶液 其中,c(H+)最大的是______,c(OH-)最大的是______. (2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示. 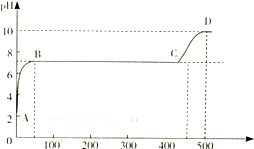 刚开始滴人碳酸钠溶液时发生反应的离子方程式为______,BC段发生反应的离子方程式为______,D点时混合溶液中由水电离产生的c(OH-)=______mol?L-1. 参考答案:(1)相同条件下,酸的电离平衡常数越大,则酸的酸性越强,酸根离子的水解程度越小,则溶液中氢氧根离子浓度越小,氢离子浓度越大,根据电离平衡常数知,酸性强弱顺序是:草酸>草酸氢根离子>碳酸>碳酸氢根离子,离子水解强弱顺序是:碳酸根离子>碳酸氢根离子>草酸根离子>醋酸氢根离子, 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《反应速率与.. | |