1、简答题 下列是治疗口腔炎症的药物华素片(西地碘片)的部分使用说明:
| 使用说明书 |
主要成分
活性分子碘含量:1.5mg/片
贮藏
遮光、密闭、在阴凉处保存
有效期
二年
|
请根据上述说明回答:
(1)推断华素片______(填“是”或“不是”)白色.
(2)某同学欲证实该药片中确定含有分子碘,设计并完成如下实验:
①将药片研碎、溶解、过滤,所得滤液分装于甲、乙两支试管中备用.
②在甲试管中加入下列一种试剂,振荡、静置,观察到液体分层,上层液体颜色为______色,所加试剂为下列中的______,由此说明分子碘的存在.
A.苯 B.酒精 C.四氯化碳 D.盐酸
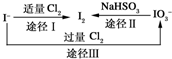
(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如下转化关系:
①如以海水为原料制取I2,加入的Cl2要适量,如过量就会发生途径Ⅲ的副反应,在该反应产物中,IO3-与Cl-的物质的量之比为1:6,则氧化剂和还原剂的物质的量之比为______.
②如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应离子方程式是______.
参考答案:(1)治疗口腔炎症的药物华素片(西地碘片)的使用说明书中介绍药物的主要成分分子碘,碘分子的颜色为紫黑色,故答案为:不是;
(2)②碘在苯中的溶解度大于在水中的溶解度,且碘与苯不反应,水与苯不互溶,碘在苯中在上层;碘在CCl4中的溶解度大于在水中的溶解度,且碘与CCl4不反应,水与CCl4不互溶,碘在CCl4中在水的下层,
故答案为:紫红(或无);A(或C);
(3)①氯气和碘离子发生氧化还原反应的方程式为:3Cl2+I-+3H2O=6Cl-+IO3-+6H+,当该反应产物中,IO3-与Cl-的物质的量之比为1:6时,氧化剂氯气和还原剂碘离子的物质的量之比为3:1,故答案为:3:1;
②如以途径Ⅱ在溶液中制取I2,IO3-作氧化剂,反应物中+5价的碘被还原成0价的碘,HSO3-具作还原剂,+4价的硫被氧化成+6价的硫,
故答案为:2IO-+5HSO3-═5SO42-+H2O+3H++I2.
本题解析:
本题难度:简单
2、实验题 图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。


(1)图Ⅰ中仪器B的名称:_______________________。
(2)①同学甲利用图Ⅰ装置制备并收集干燥的NO2气体,请在方框内画出用集气瓶收集NO2的装置图(含尾气处理装置)。
②B中发生反应的离子方程式为________________。
(3)同学乙利用图Ⅰ装置通过称量反应前后C的质量,确定Na2CO3和NaCl固体混合物中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
①_________________________; ②_________________________。
(4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向a→b→c→h连接各仪器。

①B内需加入固体试剂的名称为____________________,B中能产生氨气和氧气混合气体的原因是____________________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有_________性,E中发生反应的两个化学方程式为:____________________________和2NO + O2 =2NO2。
参考答案:(1)圆底烧瓶(2)① ;②Cu+4H++2NO3-==Cu2++ 2NO2↑+2H2O(3)①没有吸收圆底烧瓶中水蒸气的装置(或CO2中混有的水蒸气也会被C吸收);
;②Cu+4H++2NO3-==Cu2++ 2NO2↑+2H2O(3)①没有吸收圆底烧瓶中水蒸气的装置(或CO2中混有的水蒸气也会被C吸收);
②干燥管与空气相通,空气中的CO2和水蒸气也会被吸收(或反应结束后,装置内残留的CO2不能完全排除)(答案合理即可)
(4)①过氧化钠;过氧化钠与浓氨水中的H2O反应生成氢氧化钠和氧气,同时放出大量热,温度升高使氨的溶解度减小而逸出,氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出
②还原性;4NH3+5O2 4NO+6H2O
4NO+6H2O
本题解析:
本题难度:困难
3、选择题 能够直接鉴别Na2CO3、BaCl2、NaCl三种溶液的试剂是( )
A.AgNO3溶液
B.稀硫酸
C.稀硝酸
D.NaOH溶液
参考答案:A、BaCl2、NaCl、Na2CO3与AgNO3溶液反应都生成沉淀,无法鉴别,故A错误;
B、稀硫酸与BaCl2反应生成沉淀,稀硫酸与Na2CO3反应生成气体,稀硫酸与不NaCl反应,现象不同,可鉴别,故B正确;
C、稀硝酸与BaCl2、NaCl不反应,无法鉴别BaCl2、NaCl,故C错误;
D、氢氧化钠和碳酸钠、氯化钡以及氯化钠均不反应,无法鉴别,故D错误.
故选B.
本题解析:
本题难度:简单
4、实验题 锂离子电池的广泛应用使回收利用锂资源成为重要课题.某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下
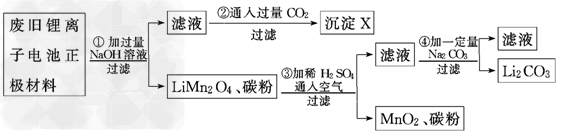
(1)第②步反应得到的沉淀X的化学式为________.
(2)第③步反应的离子方程式是_______________________________________________.
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有_____________________________.若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:_________________________________________________________.
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1?g,第③步反应中加入20.0?mL?3.0?mol/L的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有________g?Na2CO3参加了反应.
参考答案:(1)Al(OH)3
(2)4LiMn2O4+4H++O2==8MnO2+4Li++2H2O
(3)烧杯、漏斗、玻璃棒 玻璃棒下端靠在滤纸的单层处,导致滤纸破损,漏斗中液面高于滤纸边缘(其他合理答案均可)
(4)6.4(或6.36)
本题解析:
本题难度:一般
5、实验题 (1)下图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
回答下列问题:
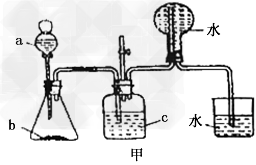
①气体X的分子式是____________。
②所选择的药品a是_________,b是___________?,?c是___________。
③下列装置乙和丙,能代替装置甲的简易装置是____________(填“乙”或“丙”)
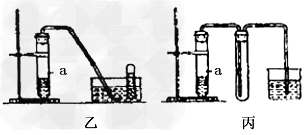
④请写出在试管a中所发生反应的化学方程式_________________。
⑤从反应开始到反应结束,预期在试管a中可观察到的气体的实验现象有哪些,请依次逐步写出________________;___________________;
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量均过量的浓硝酸或稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为_______(填“正确”或“不正确”),
依据是:_________________;
(3)另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象:__________________。
参考答案:(1)①?NO;②?a稀硝酸;b铜屑;c蒸馏水;③?乙;④3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;⑤试管a的溶液中有无色气泡产生;试管a上部空间气体由无色变成红棕色,又变无色
(2)不正确;依据是:铜片质量相同,生成铜离子的物质的量相同,溶液体积相同且硝酸过量,故生成的Cu2+的浓度相同
(3)方案及实验现象:将绿色溶液加热,有红棕色气体产生,溶液变成蓝色,说明后一种推断正确(其它合理方案均可)
本题解析:
本题难度:一般