1、实验题 海产品中常含有较多的碘元素,因此海边的居民很少患碘缺乏病。某化学兴趣小组的同学通过以下步骤提取海带中的碘:
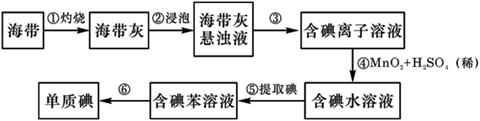
(1)步骤 ③ 用到的玻璃仪器主要有漏斗、烧杯和?。
(2)步骤 ⑤ 用有机溶剂苯将碘从水中提取出来的过程叫?。静置分层后下层液体是?。
(3)我国从1994年起推出全民食用加碘盐工程,至今,覆盖率已超过95%,补碘成效显著。我们可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾(KIO3),反应后可观察到溶液变蓝,该反应的离子方程式为____?_。
参考答案:(1)玻璃棒?(2)萃取、水?(3) IO3— + 5I— + 6H+? =? 3I2 + 3H2O
本题解析:(1)步骤 ③是过滤,还需要玻璃棒引流。
(2)有机溶剂苯将碘从水中提取出来的过程叫萃取。苯的密度小于水的,所以下层是水层。
(3)碘酸钾具有氧化性,在顺序条件下能氧化碘化钾生成单质碘,方程式为IO3— + 5I— + 6H+? =? 3I2 + 3H2O。
本题难度:一般
2、实验题 已知SO2、SiO2、CO2等氧化物化学物质具有一定的相似性。用下图所示装置进行Mg与SO2反应的实验。

(1)选择制取SO2的合适试剂?(填编号);
①20%的HNO3溶液②80%的H2SO4溶液③Na2SO3固体④CaSO3固体
(2)在方框中画出B的装置图并注明试剂;
(3)实验后对C装置玻璃管中的固体成分进行分析,未检测到单质硫,则Mg与SO2反应的产物除MgO外另一种是?(填化学式),请用实验加以证明?。
参考答案:( 1)②③(2分)(2)
1)②③(2分)(2) (2分,其它合理答案也给分)
(2分,其它合理答案也给分)
(3)MgS(2分);取少量固体于试管中,加入稀硫酸,放出有臭鸡蛋气味的气体(2分,其它合理答案也给分)
本题解析:略
本题难度:一般
3、选择题 除去乙烷中少量乙烯的最好方法是( )
A.通过足量的溴的四氯化碳溶液
B.通过足量的溴水
C.先通过足量的酸性高锰酸钾溶液,再通过碱石灰
D.催化加氢
参考答案:A.通过足量的溴的四氯化碳溶液,乙烯与溴发生加成反应,乙烷部分溶于四氯化碳,且气体中可能混有溴蒸汽和水蒸气;
B.通过足量的溴水,可除去乙烯,但乙烷中可能混有溴蒸汽和水蒸气;
C.先通过足量的酸性高锰酸钾溶液,乙烯被氧化生成二氧化碳气体,再通过碱石灰,气体中的水、二氧化碳可被吸收,进而得到纯净的乙烷;
D.催化加氢要求高温高压条件,在实验室中难以完成,且不能确定乙烯的量的多少,易得到乙烷和氢气的混合物.
综上分析,最好的方法为C,
故选C.
本题解析:
本题难度:一般
4、简答题 工业上利用硫酸渣(含Fe2-、Fe3-的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如图:
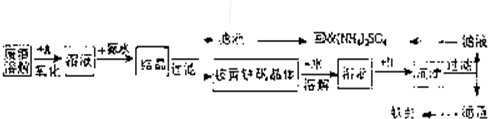
回答下列问题:
(1)在废渣溶解操作时,应选用______溶解(填编号).
A.硫酸? B.盐酸? C.氢氧化化钠? D.氨水
(2)物质A是一种氧化剂,工业上最好选用______(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是______.
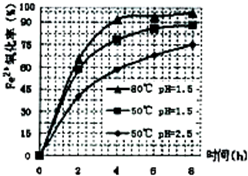
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是______.
(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:______.
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式:
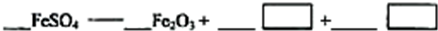
参考答案:(1)在废渣溶解操作时,目的是溶解氧化物,制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,不能引入杂质离子;
A、硫酸能溶解氧化钙和氧化镁,且不引入杂质离子,故A符合;
B、盐酸溶解氧化钙和氧化镁,但引入氯离子不能除去,故B不选;
C、氢氧化钠溶液沉淀铁离子和亚铁离子不能溶解氧化钙、氧化镁,故C不选;
D、氨水不能溶解氧化物,能沉淀铁离子和亚铁离子,故D不选;
故答案为:A;
(2)氧化剂主要是氧化亚铁离子便于提取,氯气有毒乙污染空气,二氧化锰是难溶于水的固体,空气来源丰富,成本低,不引入杂质,不产生污染,
故答案为:空气;原料来源容易,成本低,不产生污染,不引入杂质;
(3)分析图象可知在80°C时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4小时左右,
故答案为:溶液温度为80℃,pH为1.5,时间为4小时左右;
(4)往铵黄铁矾加入溶液B为氨水,至pH为5时产生沉淀,生成的是氢氧化铁沉淀反应离子方程式为:Fe3++3NH3?H2O=Fe(OH)2↓+3NH4+,
故答案为:Fe3++3NH3?H2O=Fe(OH)2↓+3NH4+;
(5)硫酸亚铁受热分解制的铁红为Fe2O3,依据氧化还原反应和电子守恒分析判断做氧化剂元素化合价降低的是硫元素化合价变化为+4价,依据原子守恒配平写出化学方程式为:2FeSO4=Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4=Fe2O3+SO2↑+SO3↑.
本题解析:
本题难度:一般
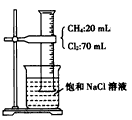
5、实验题 I.如图所示,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的烧杯中进行实验,对实验现象及产物分析错误的是_________。
A.混合气体的颜色变浅,量筒中液面上升
B.量筒内壁上出现的油状液滴,应是三氯甲烷、四氯甲烷的混合物
C.烧杯中有白色固体物质析出
D.甲烷与氯气反应后的产物只有CCl4
Ⅱ.根据烯烃的性质回答下列问题。
(1)一瓶无色气体,可能含有CH4和CH2=CH2其中的一种或两种,与一瓶Cl2混合后进行光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?__________________。②上述实验中可能涉及的反应类型有________________。
(2)含有 的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。①广泛用作农用薄膜的聚氯乙烯塑料,是由
的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。①广泛用作农用薄膜的聚氯乙烯塑料,是由 聚合而成的,其聚合的化学方程式是__________________________。 ②电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯
聚合而成的,其聚合的化学方程式是__________________________。 ②电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯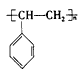 它是由_____________________(写结构简式)聚合而成的。
它是由_____________________(写结构简式)聚合而成的。
参考答案:Ⅰ.BD
Ⅱ.(1)①不正确,因为CH2=CH2与Cl2可以发生加成反应,而使黄绿色逐渐褪去,生成的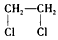 也是无色油状液体;②取代反应、加成反应
也是无色油状液体;②取代反应、加成反应
(2)①
②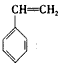
本题解析:
本题难度:一般