| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《原电池原理》考点预测(2019年强化版)(二)
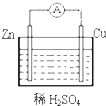 参考答案:A、原电池是化学能转化为电能的装置,故A正确; 本题解析: 本题难度:简单 2、选择题 下列叙述中正确的有 参考答案:A 本题解析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,①不正确;某反应的△H=+100kJ/mol,则该反应是吸热反应,所以该反应的正反应活化能比逆反应活化能大100kJ/mol,②正确;碳酸铵在室温条件下能自发分解产生氨气,而该反应是吸热反应,则根据△G=△H-T·△S可知,体系的熵增大,③正确;溶液导电性强弱只与溶液中离子浓度及离子所带电荷数有关系,所以强电解质水溶液的导电能力不一定比弱电解质水溶液的导电能力强,④不正确;Mg比Al活泼,在Mg和Al形成的原电池中,Mg不一定做负极,例如如果用氢氧化钠溶液做电解质溶液,则铝是负极,镁是正极,⑤不正确;锌的金属性强于铁,与铁构成原电池时锌是负极,铁是正极,被保护。所以轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法进行保护法,⑥正确,答案选A。 本题难度:一般 3、填空题 如图所示的装置中,甲为铜锌原电池,A、B均为石墨电极,请回答下列问题: 参考答案:(1)负 Cu (2)CuCl2 本题解析:(1)锌比铜活泼,且锌能和稀硫酸反应,所以甲装置是原电池,乙装置是电解池。其中锌是负极,B电极是阴极,溶液中的铜离子在阴极放电,生成单质铜。 本题难度:一般 4、选择题 下列关于原电池的叙述中,正确的是 参考答案:D 本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可知选项D正确,ABC都是错误的,答案选D。 本题难度:一般 5、填空题 (16分)(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0 kJ。写出该反应的热化学方程式 。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18g液态水,并放出515kJ热量,则CH4的物质的量为 。 参考答案: (1)CH4(g)+ 2O2(g)==CO2(g)+ 2H2O(l) △H = -890.0kJ/mol 0.5 (2)负 CH4—8e- + 10OH- ="=" CO32- + 7H2O (3)2CuSO4+2H2O 本题解析:(1)燃烧热就是1mol物质完全燃烧生成稳定氧化物放出的热量。根据题意CH4的燃烧热化学方程式为:CH4(g)+ 2O2(g)==CO2(g)+ 2H2O(l) △H = -890.0kJ/mol,水只能由CH4燃烧生成,18g液态水的物质的量为1mol,根据反应中的计量数关系,生成1mol水需要消耗CH4物质的量为0.5mol,(2)燃料电池中燃料反应的一极是负极,发生的电极反应为CH4—8e- + 10OH- ="=" CO32- + 7H2O.(3)根据电子的移动方向知道石墨做阳极,Fe做阴极,装置就是电解CuSO4溶液,方程式为2CuSO4+2H2O 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《分子式、结.. | |