1、选择题 实验室中有一瓶久置的白色粉末,元素分析证明它是由钾、硫、氧三种元素组成,钾和硫的质量比为39:16,下列结论正确的是( )
A.根据元素分析结果推测该粉末为纯净物
B.将粉末溶于水,加入氯化钡,观察到有白色沉淀生成,证明原粉末是硫酸钾
C.将粉末加入盐酸中,产生气泡,证明原粉末是亚硫酸钾
D.将粉末溶于水,加入氯化钡和盐酸,观察到有白色沉淀和气泡生成,证明原粉末是硫酸钾和亚硫酸钾的混合物
2、选择题 在实验室,称取一定量的粗盐经溶解、过滤、结晶等操作,可得到较纯净的食盐.下列图示对应的操作不规范的是( ? )
A.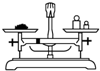
称量
B.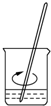
溶解
C.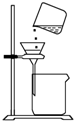
过滤
D.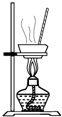
结晶
3、填空题 为测定硫酸亚铁铵晶体【(NH4)2Fe(SO4)2?xH2O】中铁的含量,某实验小组做了如下实验:
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/LKMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+.
再重复步骤二两次.
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、______、转移、洗涤并转移、______、摇匀.
(2)用______滴定管盛放KMnO4溶液.
(3)当滴入最后一滴KMnO4溶液,出现______,即到达滴定终点.反应的离子方程式:______
(4)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
25.00
1.05
21.04
2
25.00
1.50
24.50
3
25.00
0.20
20.21
|
实验测得该晶体中铁的质量分数为______.(保留两位小数)
(5)根据步骤二填空:
①滴定管用蒸馏水洗涤后,直接加入KMnO4标准溶液进行滴定,则测得样品中铁的质量分数将______.(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,未干燥,则滴定时用去KMnO4标准溶液的体积将______(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察______.
A、滴定管内液面的变化B、锥形瓶内溶液颜色的变化
④滴定后俯视读数,测得样品中铁的质量分数将______(填“偏高”、“偏低”或“无影响”).
4、填空题 食盐水中含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得较纯净的食盐水:
①加入稍过量的Na2CO3溶液
②加入稍过量的NaOH溶液
③加入稍过量的BaCl2溶液
④滴入稀盐酸至无气泡产生
⑤过滤
正确的操作顺序是______.
5、选择题 下列实验操作中错误的是( )
A.蒸发过程中必须用玻璃棒不断搅拌,以防止局部温度过高而使液体飞溅
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗里下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大