1、选择题 短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍.下列说法正确的是( )
A.Z元素形成的某种氧化物能使品红溶液褪色
B.X和Z的最高价氧化物对应的水化物都是弱酸
C.X与Y元素形成的化合物的相对分子质量是100g?mol-1
D.Y元素形成的单质能在氧气中燃烧但不能在二氧化碳中燃烧
参考答案:Z原子最外层电子数是X原子内层电子数的3倍,是Y原子最外层电子数的3倍,说明Z原子最外层6个电子,Y原子最外层2个电子,又X与Y、Z位于相邻周期,三原子的最外层电子数之和为13,可以推知X、Y、Z分别是N、Mg、S,则
A.Z元素形成的氧化物有SO2、SO3等氧化物,其中SO2具有漂白性,能使品红褪色,故A正确;
B.X和Z的最高价氧化物对应的水化物硝酸和硫酸,都是强酸,故B错误;
C.X与Y元素形成的化合物为Mg3N2,相对分子质量为100,故C错误;
D.Mg可在CO2中燃烧生成MgO和C,故D错误.
故选A.
本题解析:
本题难度:简单
2、简答题 已知由短周期元素组成的A、B、C、D四种化合物所含原子数目依次为2、3、4、5,其中A、B、C含有18个电子,D含有10个电子.请回答
(1)A、B、D的化学式分别是A______;B______;D______.?
(2)已知8gD与O2完全反应,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式______.
(3)若C为第一和第二周期元素组成的化合物.
①C的溶液中加入少量的二氧化锰,有无色气体生成,写出化学方程式______;
②C的溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,反应中二氧化锰做______剂;
③当C分别发生①和②两个反应时,若都有1molC完全反应,①和②两个反应中转移电子数之比是:______.
参考答案:(1)由短周期两原子组成的18电子的化合物为HCl,三原子组成的18电子的化合物为H2S,四原子组成的18电子化合物为PH3或H2O2,由短周期五原子组成的10电子的化合物为CH4.A、B、D四种化合物所含原子数目依次为2、3、5,其中A、B含有18个电子,D含有10个电子,故A为HCl,B为H2S,D为CH4.
故答案为:HCl、H2S、CH4.
(2)8gCH4的物质的量为8g16g/mol=0.5mol,根据题意1molCH4完全燃烧放出热量为:1mol0.5mol×445kJ=-890kJ,则其反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ?mol-1.
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ?mol-1.
(3)若C为第一和第二周期元素组成的化合物,则C为H2O2.
①H2O2在二氧化锰作用下会迅速产生氧气:2H2O2?MnO2?.?2H2O+O2↑;
故答案为:2H2O2?MnO2?.?2H2O+O2↑.
②H2O2溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,锰元素化合价降低,二氧化锰做氧化剂;
故答案为:氧化剂.
③对于反应2H2O2?MnO2?.?2H2O+O2↑,1molH2O2完全反应,转移电子1mol,对于反应H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑,1molH2O2完全反应,转移电子2mol,两个反应中转移电子数之比是1:2.
故答案为:1:2.
本题解析:
本题难度:一般
3、选择题 R为1~18号元素,其原子所具有的电子层数为最外层电子数的
,它可能形成的含氧酸根离子有:①R2 ,②R,③R2 ,④R,下列叙述判断正确的是( )
A.当它可以形成①时,不可能形成④
B.当它可以形成②时,可以形成③和④
C.当它可以形成①时,不可能形成②和③
D.当它形成②时,也可以形成①
参考答案:R为1~18号元素,其原子所具有的电子层数为最外层电子数的12,若R的电子层为1,则核外电子数为2,为He元素,He性质稳定,没有含氧酸根;若R的电子层为2,则最外层电子数为4,为C元素;若R的电子层为3,则最外层电子数为6,为S元素.
A、当R可以形成①R2 O42-时,是C2 O42-,故R为C元素,C元素可以形成CO32-,故A错误;
B、当R可以形成②RO42-时,R为+6价,故R为S元素,S元素可以形成S2 O32-,SO32-,故B正确;
C、当R可以形成①R2 O42-时,是C2 O42-,故R为C元素,C元素不可能形成RO42-、R2O32-形式结构的离子,故C正确;
D、当R可以形成②RO42-时,R为+6价,故R为S元素,S元素可以形成S2 O32-,SO32-,不可能形成R2 O42-形式结构的离子,故D错误.
故选:BC.
本题解析:
本题难度:简单
4、填空题 有原子序数均小于20的A、B、C、D四种元素,已知:①A和B在同一主族,C和D在同一周期;②四元素相互间可形成A2C、A2C2、B2C2、DC2等化合物;③B的阳离子与C的阴离子核外电子层结构相同;④B2C2与A2C或DC2反应都生成C2气体;⑤B的单质与A2C反应生成A2气体,A2与C2混合遇火可发生爆炸,生成常温下无色、无味的液体A2C.试回答:
(1)写出A和D两元素的名称:A______、D______
(2)画出B离子和C离子的结构示意图______,______.?两种离子中,半径较小的是______(填离子符号).
(3)写出A2C2、B2C2的电子式:A2C2______ ?B2C2______
(4)写出B2C2与DC2反应的化学方程式______.
参考答案:由信息可知,常温下无色、无味的液体A2C为H2O,则利用①②③④⑤可推出A为H,B为Na,C为O,D为C,
(1)A为H,其名称为氢,D为C,其名称为碳,故答案为:氢;碳;
(2)B为钠,易失去1个电子,则钠离子的结构示意图为

,C为O,易得到2个电子,其离子结构示意图为
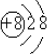
,两种离子具有相同的电子层排布,原子序数大的离子半径小,则Na+的离子半径小,故答案为:

;
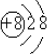
;Na+;
(3)A2C2为H2O2,是共价化合物,其电子式为
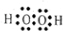
,B2C2为Na2O2,是离子化合物,其电子式为
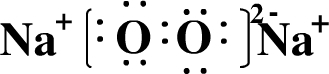
,
故答案为:
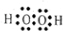
;
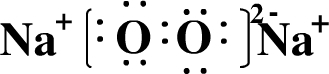
;
(4)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
本题解析:
本题难度:一般
5、简答题 X、Y、Z、W、R是五种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y元素原子的最外层电子数是其次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.请填写下列空白:
(1)画出W的原子结构示意图;______.
(2)Z和W最高价氧化物的水化物的碱性较强的是:______(写化学式),它们之间在溶液中反应的离子方程式是;______;
(3)Z2Y2中阴离子的化学式是______.
(4)在同周期元素中,R?元素及与其相邻元素的原子半径从大到小的顺序是:______.与R元素同周期且非金属性最强的元素是:______.
(5)W的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,其反应的化学方程式是:______.
参考答案:X、Y、Z、W、R是五种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,则X为氢元素;Y元素原子的最外层电子数是其次外层电子数的3倍,则Y有2个电子层,最外层电子数为6,则Y为氧元素;R与Y处于同一族,则R为硫元素,Z、W、R处于同一周期,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,Z、W的原子序数小于R的原子序数,原子序数Z<W,故Z为钠元素,W为铝元素.
故X为氢元素;Y为氧元素;Z为钠元素,W为铝元素,R为硫元素.
(1)W为Al元素,原子核外有13个电子,有3个电子层,最外层有3个电子,原子结构示意图
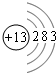
,故答案为:

;
(2)Z为钠元素,W为铝元素,同周期自左而右金属性减弱,所以金属性Na>Al,金属性越强,最高价氧化物的水化物的碱性越强,所以碱性NaOH>Al(OH)3;氢氧化钠与氢氧化铝反应生成偏铝酸钠与氢气,在溶液中反应的离子方程式是?Al(OH)3+OH-=AlO2-+2H2O,
故答案为:NaOH;Al(OH)3+OH-=AlO2-+2H2O;
(3)Z2Y2是Na2O2,阴离子的化学式是O22-,故答案为:O22-;
(4)R为硫元素,在同周期元素中,与S元素相邻元素为P元素、Cl元素,同周期自左而右原子半径减小,所以从大到小的顺序是P>S>Cl.同周期自左而右非金属性增强,所以与S元素同周期且非金属性最强的元素是氯元素,故答案为:P>S>Cl;氯;
(5)Al、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,为Al2O3、TiC,其反应的化学方程式为4Al+3C+3TiO2?高温?.?2Al2O3+3TiC.
故答案为:4Al+3C+3TiO2?高温?.?2Al2O3+3TiC.
本题解析:
本题难度:一般