1、选择题 25℃,a L 0.1000mol/L CH3COOH溶液与b L 0.1000 mol/L NaOH溶液混合,下列说法正确的是(?)
A.若a>b,则pH一定小于7
B.若a<b,则一定存在:n(OH-)-n(H+)>0.1(b-a)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则a≤b
D.若pH=7,则a>b,且c(Na+)=c(CH3COO-)+c(CH3COOH)
参考答案:B
本题解析:若a>b,则醋酸过量,但溶液可能显中性,A不正确。若a<b,则氢氧化钠过量,根据电荷守恒可知,n(OH-)-n(H+)=n(Na+)-n(CH3COO-)。由于醋酸钠水解,所以溶液中n(CH3COO-)小于0.1amol,因此选项B正确。当醋酸过量时,也可能显碱性,C不正确。溶液显中性时,醋酸一定是过量的,所以c(Na+)<c(CH3COO-)+c(CH3COOH),D不正确,答案选B。
本题难度:一般
2、选择题 已知温度T时水的离子积常数为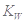 。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,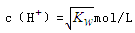
D.混合溶液中,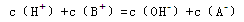
参考答案:C
本题解析:A.因酸碱的强弱未知,a=b,只能说明酸碱恰好完全反应,但如为强酸弱碱盐或强碱弱酸盐,则溶液不呈中性,故A错误;B.因温度未知,则pH=7不一定为中性,故B错误;C.混合溶液中,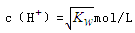 ,根据c(H+)?c(OH-)=KW,可知溶液中c(OH-)=
,根据c(H+)?c(OH-)=KW,可知溶液中c(OH-)=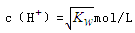 ,溶液呈中性,故C正确;D.任何溶液都存在电荷守恒,即c(H+)+c(B-)=c(OH-)+c(A-),不能确定溶液的酸碱性,故D错误;故选C。
,溶液呈中性,故C正确;D.任何溶液都存在电荷守恒,即c(H+)+c(B-)=c(OH-)+c(A-),不能确定溶液的酸碱性,故D错误;故选C。
本题难度:一般
3、选择题 常温下,向0.1mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如下图所示,下列有关说法中正确的是?(?)
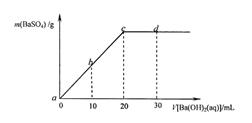
A.溶液的导电能力:a>b>c>d
B.溶液的pH:a>b>c>d
C.b溶液中的H+溶液和d溶液中的OH-浓度相等
D.c溶液和d溶液都呈碱性
参考答案:B
本题解析:略
本题难度:一般
4、选择题 常温下,要使0.1mol?L-1醋酸的电离程度和pH都减小,同时又使醋酸根离子浓度增大,可加入的试剂是:(?)
A.CH3COONa浓溶液
B.1mol?L-1氨水
C.1mol?L-1H2SO4
D.2mol?L-1CH3COOH
参考答案:D
本题解析:醋酸为弱电解质,所以增加醋酸的浓度,可以使其电离程度减小,同时增加醋酸的浓度可以使其的pH减小,所以要使0.1mol?L-1醋酸的电离程度和pH都减小,同时又使醋酸根离子浓度增大,可加入的试剂是2mol?L-1CH3COOH,本题的答案选择D。
点评:本题考查了弱电解质的电离度与其浓度的关系,属于对基础知识的考查,本题可以考查学生对基础知识的掌握情况,本题比较容易。
本题难度:简单
5、选择题 25℃时,pH=2的HCl溶液中,由水电离出的c(H+)浓度是?
A.1×10-7mol·L-1
B.1×10-12mol·L-1
C.1×10-2mol·L-1
D.1×10-14mol·L-1.
参考答案:B
本题解析:25℃时,Kw=1×10-14,pH=2的HCl溶液,酸电离出的c(H+)=1×10-2mol/L,由水电离出的C(OH-)=1×10-12mol·L-1,水电离出的C(OH-)和水电离出的c(H+)相等,所以由水电离出的c(H+)浓度是1×10-12mol·L-1,故选B。
本题难度:简单