1、选择题 向纯水中加入少量下列物质或改变下列条件,能促进水的电离,并能使溶液中c(OH—) > c(H+)的操作是: ①稀硫酸?②金属钠?③氨气?④FeC13固体?⑤NaClO固体?⑥将水加热煮沸
A.②⑤
B.①④
C.③④⑥
D.④
参考答案:A
本题解析:考查影响水的电离的外界因素。盐的水解能促进水的电离,但酸或碱是抑制水的电离的,因此①③抑制。加入金属钠,和水电离出的氢离子反应生成氢氧化钠和氢气,使水的电离向右移动,碱性增强,c(H+)<c(OH-);加热促进水的电离,但水中c(OH—)=c(H+);氯化铁水解,溶液显酸性。次氯酸钠水解,溶液显碱性,所以正确的答案选A。
本题难度:一般
2、实验题 (11分)用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用?(填编号字母)作指示剂。
(A)甲基橙?(B)石蕊?(C)酚酞?
(2)若选用甲基橙作指示剂,滴定终点的判断方法是?
?,此时溶液显?性。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是?mol·L-1。]
滴定次数
| 待测溶液体积(mL)
| 标准酸体积
|
滴定前的刻度(mL)
| 滴定后的刻度(mL)
|
第一次
| 10.00
| 0.40
| 20.50
|
第二次
| 10.00
| 4.10
| 24.00
|
第三次
| 10.00
| 0.40
| 21.50
|
?
(4)分析下列实验操作会对滴定结果产生的影响。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果?。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果?。
③若烧碱溶液隔夜后滴定,选用甲基橙作指示剂时,则滴定结果?。
参考答案:(1) (B)?(2) 当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟内不褪色 酸?(3)? 0.4000?(4)①?偏高? ②?偏高?③无影响?(各2分)
本题解析:(1)因为石蕊试液的颜色变化不明显,不便于观察,所以不能选用石蕊试液作指示剂。
(2)甲基橙的变色范围是3.1~4.4,即溶液是显酸性的。所以盐酸滴定碱液终点的变化是当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟内不褪色。
(3)三次实验中消耗盐酸的体积分别为20.10ml、19.90ml、21.10ml,所以第三次的实验误差大,所以取前2次的平均值,即盐酸的体积是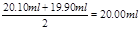 ,所以烧碱溶液的物质的量浓度是
,所以烧碱溶液的物质的量浓度是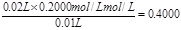 。
。
(4)开始俯视,则读数偏小,滴定终点平视,所以最终盐酸的体积偏大,结果偏高。锥形瓶用待测液润洗,则氢氧化钠的量偏多,消耗盐酸的体积偏大,结果偏高。烧碱溶液隔夜后滴定,则会含有杂质碳酸钠,但甲基橙的变色范围是在酸性环境中,所以根据原子守恒可知,消耗的盐酸是相同,不影响测定结果。
本题难度:一般
3、选择题 100℃时,Kw=10-12,将100℃时pH=10的NaOH溶液和pH=1的H2SO4混合,所得混合溶液的pH=2,则NaOH溶液和H2SO4溶液的体积比是
A.11 : 1
B.12 : 11
C.9 : 2
D.9: 1
参考答案:C
本题解析:Kw=10-12,NaOH溶液中氢氧根则为10-2 mol/L,氢氧化钠中氢氧根的物质的量浓度为0.01mol/L,硫酸中氢离子的物质的量浓度为0.1mol/L。
设氢氧化钠体积为X,硫酸体积为Y。
(0.1Y-0.01X)÷(X+Y)=0.01
化简得:X:Y=9:2,故选C。
点评:对于酸碱混合的计算,首先要判断混合液的酸碱性。属于较简单题。
本题难度:一般
4、选择题 常温下,向0.1mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如下图所示,下列有关说法中正确的是?(?)
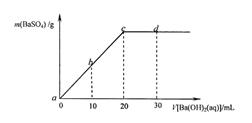
A.溶液的导电能力:a>b>c>d
B.溶液的pH:a>b>c>d
C.b溶液中的H+溶液和d溶液中的OH-浓度相等
D.c溶液和d溶液都呈碱性
参考答案:B
本题解析:略
本题难度:一般
5、选择题 向10 mL 0.1mol·L-1的Na2CO3溶液中通入22.4mL(标准状况)CO2,当气体全部溶解时,溶液中粒子浓度关系正确的是
A.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B.c(HCO3-)=c(Na+)>c(OH-)>c(H+)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+)
参考答案:C
本题解析:
正确答案:C
n(CO2)=0.001mol,n(Na2CO3)= =0.001mol,充分反应后,溶液为:NaHCO3溶液
A.不正确,c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) ,NaHCO3电离为主,水解量少;
B.c(HCO3-)=c(Na+)不正确,HCO3―要水解;
C.正确,物料守恒:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)?
D.不正确:质子守恒:c(HCO3-)+c(OH-)=c(H2CO3)+c(H+)
本题难度:简单