1、填空题 pH = 2与pH = 5的两强酸溶液各10 mL,混合后溶液的pH为?。
参考答案:3-lg5
本题解析:考查溶液pH的计算
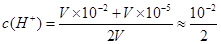 ,pH=lg
,pH=lg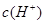 =3-lg5
=3-lg5
本题难度:简单
2、选择题 下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A.NH3(g)+
O2(g)═NO(g)+H2O(g);△H=-akJ?mol-1
B.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ?mol-1
C.2CO(g)+O2(g)═2CO2(g);△H=-ckJ?mol-1
D.CH3CH2OH(l)+O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ?mol-1
参考答案:A、热化学方程式中的水是气体,不是最稳定的氧化物,故A错误;
B、1molC6H12O6(s)完全燃烧生成了稳定的氧化物二氧化碳和液态水,符合燃烧热的概念,故B正确;
C、热化学方程式中是2mol可燃物一氧化碳反应放出的热量,故C错误;
D、反应是催化氧化反应,生成的乙醛还可以燃烧,不符合燃烧热的概念,故D错误;
故选B.
本题解析:
本题难度:简单
3、选择题 下列有关电解质溶液关系正确的是
A.分别向pH=2的盐酸和醋酸溶液中,加水稀释到pH=4,消耗水的体积相等
B.等物质的量浓度的氯化钠和醋酸钠溶液中,微粒关系有c(Na+)= c(Cl-)+c(CH3COO-)
C.在NaHSO3溶液微粒由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
D.若弱酸的酸性H2A>H2B,则等物质的量浓度等体积的Na2A、Na2B溶液中,阴离子数目前者大于后者
参考答案:C
本题解析:选项A中盐酸为强酸,醋酸为弱酸,加水稀释时醋酸消耗水的体积大。选项B中油正负电荷守恒得c(Na+)+c(H+)= c(Cl-)+c(CH3COO-)。选项D中H2A酸性强于H2B,B2-离子与氢离子结合的能力强于A2-离子,因此Na2A的碱性弱于Na2B。再根据c(Na+)+c(H+)=c(A2-)+c(OH-) ,
c(Na+)+c(H+)=c(A2-)+c(OH-),Na+浓度相同,A中的c(H+)大于B中c(H+),可得Na2A溶液中的阴离子数多
点评:本题关键在于会利用物料守恒,及溶液的性质来判断离子浓度的大小。
本题难度:简单
4、计算题 6分)将0.3mol NaCl固体与0.1mol CuSO4?5H2O固体混合溶于水,配成1升混合液。然后取出200ml溶液,用石墨电极,通电一段时间(不考虑水解)。求Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是多少?所得溶液的PH为多少(假设溶液体积不变)?
参考答案:0.224L;? PH=13
本题解析:考查电解以及pH的有关计算。
氯离子在阳极失去电子,方程式为2Cl――2e-=Cl2↑
共计转移电子是0.3mol÷5=0.06mol
阴极是铜离子放电,方程式为Cu2++2e-=Cu
转移电子是0.1mol÷5×2=0.04mol
所以根据电子得失守恒可知,阴极氢离子得到0.06mol-0.04mol=0.02mol
生成氢气的电极反应式为2H++2e-=H2↑
所以氢气是0.01mol,其标准状况下的体积是0.224L。
同时溶液中生成氢氧化钠是0.01mol×2=0.02mol
浓度是0.02mol÷0.2L=0.1mol/L
PH=13
本题难度:一般
5、选择题 在25 ℃时,将pH = 11的NaOH溶液与pH = 3的CH3COOH溶液等体积混合后,
下列关系式中正确的是(? )
A.c(Na+) = c(CH3COO-)+c(CH3COOH)
B.c(H+)+ c(Na+) = c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
参考答案:BD
本题解析:醋酸是弱酸,存在电离平衡,所以pH=3的醋酸溶液的浓度大于0.001mol/L,因此反应后醋酸是过量的,溶液显酸性,D正确,AC不正确。B中符合电荷守恒,正确。答案选BD。
本题难度:一般