1、填空题 (4分)在温度T下,c(OH-)=0.1 mol·L-1的Ba(OH)2的PH值为11。
(1)该温度下,100ml水中含有OH-约有_?个。
(2)该温度下,在PH=8的Ba(OH)2溶液中加入PH=5的盐酸,欲使混合溶液pH=7,则Ba(OH)2溶液与所加盐酸的体积比为__? __
2、选择题 已知水的电离平衡曲线如图所示,试回答下列问题:
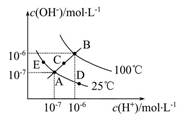
(1)图中五点Kw间的关系是?。
(2)若从A点到D点,可采用的措施是?。
a.升温?b.加入少量的盐酸? c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为?。
3、选择题 已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是? ( )
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)=
Ba(OH)2(aq)= BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
4、选择题 已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的
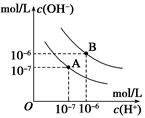
A.A曲线代表25℃时水的电离平衡曲线
B.当95℃时,pH=6的溶液呈中性
C.25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4 溶液混合,所得溶液的pH=7
D.95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸
5、选择题 下列叙述正确的是
A.c(H+)等于l×l0-7mol/L的溶液一定是中性溶液
B.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其Kw= l×l0-14
C.将水加热,Kw增大,pH不变
D.任何浓度的溶液都可以用pH来表示其酸性的强弱