| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《难溶电解质的溶解平衡》高频试题预测(2019年最新版)(五)
 SO2 +2Cu。 SO2 +2Cu。F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。 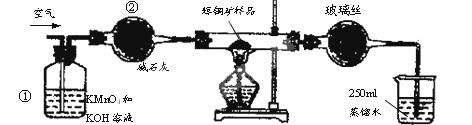 试回答下列问题: (1)装置①的作用是_________________;装置②的作用是____________________。 (2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为?,当产生_______________________________的现象时可判断滴定已经达到终点。 (3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系:c2 (H+)·(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H十)为__________________。 4、简答题 取一支洁净试管,向试管中加入0.1mol?L-1AgNO3溶液2mL,再向硝酸银溶液中加入稍过量的铜粉,反应足够长时间后,取上层清液于另一支试管中,再向该试管中滴加0.1mol?L-1KI溶液.回答有关上述实验的下列问题: 5、选择题 已知Ca(OH)2的溶解度随温度升高而降低。将某温度下饱和澄清石灰水①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是 | |||||||||||||||||||||||||||||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《与量有关的.. | |