1、填空题 工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
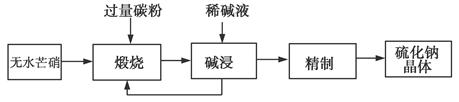
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
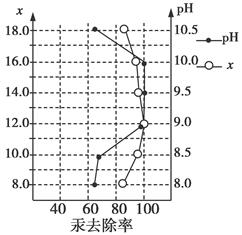
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
参考答案:(1)3Na2SO4+8C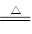 3Na2S+4CO2↑+4CO↑
3Na2S+4CO2↑+4CO↑
(2)热水能促进Na2S水解,而稀碱可抑制Na2S水解
(3)pH介于9~10之间,x=12
(4)4.0×10-36 mol/L
(5)阴极 降低
2Cu2++2e-+H2O=Cu2O↓+2H+
本题解析:(1)由题意分析知反应除生成等物质的量的CO和CO2外还生成Na2S,注意条件为加热。(2)Na2S是强碱弱酸盐,水解后溶液显碱性,加热会促进S2-水解,而加碱则可以抑制其水解。(3)由图像可知当pH介于9~10时,x=12时汞的除去率最大。(4)pH=4,则c(OH-)=10-10 mol/L,根据Cu(OH)2溶度积可求得c(Cu2+)=2.2 mol/L,代入CuS的溶度积求得c(S2-)=4×10-36 mol/L。(5)Cu由+2价变为+1价,得电子,所以在阴极反应:2Cu2++2e-+H2O=Cu2O↓+2H+,有H+生成,所以溶液的pH降低。
点拨:本题考查化学与技术,考查考生理论联系实际的能力。难度较大。
本题难度:困难
2、选择题 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示。又知t℃时AgCl的
Ksp=4×10-10,下列说法不正确的是

[? ]
A.在t℃时,Ag2CrO4的Ksp为1×10-8
B.在饱和溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,Ag2CrO4(s)+2Cl-(aq)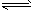 2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
D.在t℃时,以0.001mol/L AgNO3溶液滴定20mL0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,
Cl-先沉淀
参考答案:AB
本题解析:
本题难度:一般
3、填空题 (1)AgNO3的水溶液呈_____(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):________________
(2)氯化铝水溶液呈_______,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______________;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_________。?
(3) 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
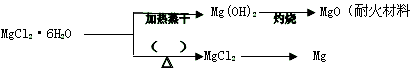
请回答下列问题: ①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固) 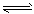 ?Mg2++2OH-。向体系中加入(请填出两种不同类别的物质________________________有利于Mg(OH)2溶解。
?Mg2++2OH-。向体系中加入(请填出两种不同类别的物质________________________有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,某温度 时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
参考答案:(1)酸;Ag++H2O  ?AgOH+H+
?AgOH+H+
(2)酸;Al3++3H2O  ?Al(OH)3+3H+;Al2O3?
?Al(OH)3+3H+;Al2O3?
(3)①HCl气流 ②酸、水、酸性气体、饱和NH4Cl等(任选两种) ③5×10-10
本题解析:
本题难度:一般
4、选择题 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

注:溶液中某种离子的浓度小于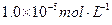 ,可认为该离子不存在;
,可认为该离子不存在;
实验过程中,假设溶液体积不变。

下列说法正确的是
A.沉淀物X为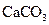
B.溶液M中存在 、不存在
、不存在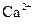
C.溶液N中存在 、
、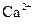
D.步骤②中若改为加入4.2g NaOH固体,沉淀物Y为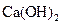 和
和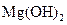 的混合物
的混合物
参考答案:A
本题解析:略
本题难度:一般
5、选择题 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀
A.溶解
B.增多
C.不变
D.无法判断