1、填空题 工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
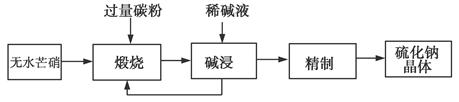
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
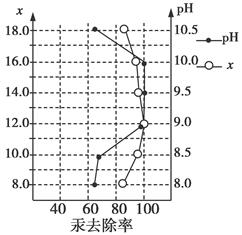
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
2、选择题 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示。又知t℃时AgCl的
Ksp=4×10-10,下列说法不正确的是

[? ]
A.在t℃时,Ag2CrO4的Ksp为1×10-8
B.在饱和溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,Ag2CrO4(s)+2Cl-(aq)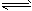 2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
D.在t℃时,以0.001mol/L AgNO3溶液滴定20mL0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,
Cl-先沉淀
3、填空题 (1)AgNO3的水溶液呈_____(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):________________
(2)氯化铝水溶液呈_______,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______________;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_________。?
(3) 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
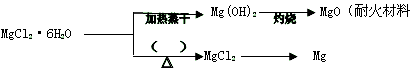
请回答下列问题: ①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固) 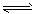 ?Mg2++2OH-。向体系中加入(请填出两种不同类别的物质________________________有利于Mg(OH)2溶解。
?Mg2++2OH-。向体系中加入(请填出两种不同类别的物质________________________有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,某温度 时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
4、选择题 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

注:溶液中某种离子的浓度小于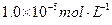 ,可认为该离子不存在;
,可认为该离子不存在;
实验过程中,假设溶液体积不变。

下列说法正确的是
A.沉淀物X为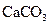
B.溶液M中存在 、不存在
、不存在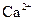
C.溶液N中存在 、
、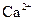
D.步骤②中若改为加入4.2g NaOH固体,沉淀物Y为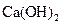 和
和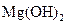 的混合物
的混合物
5、选择题 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀
A.溶解
B.增多
C.不变
D.无法判断