1、填空题 卤族元素包括______、______、______ 、______(填元素符号),随核电荷数递增,它们的原子半径依次_____________,单质的氧化性依次___________________。
参考答案:F? Cl? Br? I?增大?增强
本题解析:卤族元素包括F、Cl 、Br 、I,随核电荷数递增,它们的原子半径依次增大,单质的氧化性依次减弱。
本题难度:简单
2、选择题 右表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是

A.常温常压下,五种元素的单质中有两种是气态
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者
参考答案:A
本题解析:根据元素周期表的结构以及元素在周期表中的相对位置可知,若R为稀有气体元素,则X是N、W是P、Y是S、R是Ar、Z是Br。A、常温常压下,五种元素的单质中有两种是气态,分别是氩气和氮气,S和P是固态,单质溴是液态,A正确;B、S2-与Ar的电子层结构相同,都是18e-,但Br-是36e-微粒,与Ar的电子层结构不同,B不正确;C、同主族自上而下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,所以X的氢化物比W的氢化物稳定,C不正确;D、同周期自左向右非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强,所以Y与W元素的最高价氧化物对应的水化物的酸性比较,前者强于后者,D不正确,答案选A。
本题难度:一般
3、选择题 要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列哪组物质进行实验
A.Fe、CuSO4溶液、MgCl2溶液
B.Fe、MgCl2溶液、FeCl2溶液
C.Mg、CuO、FeSO4溶液
D.Cu、FeCl2溶液、MgCl2溶液
参考答案:A
本题解析:验证Mg、Fe、Cu三种金属的活动性顺序,可以用铁来分别置换铜与镁,置换出来,说明比铁的活泼性弱,否则比铁的活泼性强。
点评:属于简单题,
本题难度:一般
4、填空题 X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大。 X、Y可形成最常用溶剂;X、Y、Z最夕层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g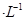 。请回答下列问题:
。请回答下列问题:
(1)Y、Z、M三种元素原子半径由小到大的顺序为(写元素符号)________________。
(2)Q在周期表中的位置是____________。
(3)X、Y、Q三种元素’形成的三原子分子结构式为______________;M、Q元素形成的最高价氧化物对应的水化物中较强的酸是(写化学式)_____________。
(4)Y与Z形成的化合物A既含离子键又含共价键,A的电子式为______________________;
将A加入盛有酚酞试液的试管中观察到的现象为_________________________________,发生反应的化学方程式为_________________。
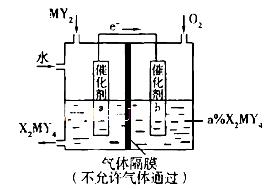
(5)利用下列装置可将化合物MY2转化为重要化工原料H2MY4。电极a的催化剂表面发生的电极反应方程式为__________________________________;理论上通人MY2与O2的物质的量最佳比值为________________。
参考答案:(1)H,O,Cl,S,Na。(2)第三周期,第VIIA族。(3)H-O-Cl;HClO4。(4)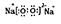 ;溶液变红,后褪色,发生反应的化学方程式为2Na2O2 + 2H2O =" 4NaOH" + O2。(5)SO2 + 2H2O -2e- = SO42- + 4H+;2:1。
;溶液变红,后褪色,发生反应的化学方程式为2Na2O2 + 2H2O =" 4NaOH" + O2。(5)SO2 + 2H2O -2e- = SO42- + 4H+;2:1。
本题解析:X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大。 X、Y可形成最常用溶剂,为水分子;可知X、Y分别为氢和氧元素。由三者最夕层电子数之和为8,推得Z为钠。Y、M形成的气态化合物在标准状况下的密度为2.86g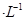 ,其相对分子质量为64,可知M为硫元素,由于是短周期元素,Q元素的原子序数比M的大,推得Q为氯。(1)Y、Z、M三种元素原子半径由小到大的顺序为(写元素符号)H,O,Cl,S,Na。(2)Q在周期表中的位置是第三周期,第VIIA族。(3)X、Y、Q三种元素’形成的三原子分子是次氯酸,结构式为H-O-Cl;M、Q元素形成的最高价氧化物是Cl2O7,其对应的水化物中较强的酸是高氯酸,化学式为HClO4。(4)Y与Z形成的化合物A是过氧化钠,既含离子键又含共价键,A的电子式为
,其相对分子质量为64,可知M为硫元素,由于是短周期元素,Q元素的原子序数比M的大,推得Q为氯。(1)Y、Z、M三种元素原子半径由小到大的顺序为(写元素符号)H,O,Cl,S,Na。(2)Q在周期表中的位置是第三周期,第VIIA族。(3)X、Y、Q三种元素’形成的三原子分子是次氯酸,结构式为H-O-Cl;M、Q元素形成的最高价氧化物是Cl2O7,其对应的水化物中较强的酸是高氯酸,化学式为HClO4。(4)Y与Z形成的化合物A是过氧化钠,既含离子键又含共价键,A的电子式为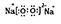 ;过氧化钠与水反应先生成氢氧化钠和过氧化氢,过氧化氢有漂白性,故将A加入盛有酚酞试液的试管中观察到的现象为溶液变红,后褪色,发生反应的化学方程式为2Na2O2 + 2H2O =" 4NaOH" + O2。(5)化合物MY2是二氧化硫,转化为重要化工原料H2MY4是硫酸,由图可知电极a发生失电子,电极反应方程式为SO2 + 2H2O -2e- = SO42- + 4H+;根据得失电子守恒,理论上通人MY2与O2的物质的量最佳比值为2:1。
;过氧化钠与水反应先生成氢氧化钠和过氧化氢,过氧化氢有漂白性,故将A加入盛有酚酞试液的试管中观察到的现象为溶液变红,后褪色,发生反应的化学方程式为2Na2O2 + 2H2O =" 4NaOH" + O2。(5)化合物MY2是二氧化硫,转化为重要化工原料H2MY4是硫酸,由图可知电极a发生失电子,电极反应方程式为SO2 + 2H2O -2e- = SO42- + 4H+;根据得失电子守恒,理论上通人MY2与O2的物质的量最佳比值为2:1。
本题难度:一般
5、选择题 华裔科学家高琨因“在光纤传输信息领域中的突破性成就”获得2009年诺贝尔物理学奖,下列有关硅材料的说法正确的是
A.光纤的主要成分是高纯度的单质硅
B.刚玉的主要成分是二氧化硅
C.28g硅含有6.02×1023个电子
D.28Si、29Si、30Si是不同的核素
参考答案:D
本题解析:略
本题难度:一般