1、填空题 1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料。镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的。从海水(主要含NaCl和MgSO4)中提取金属镁的主要步骤如下:
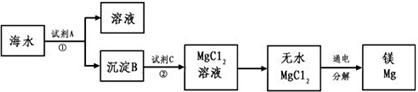
回答下列问题:
(1)Mg在周期表中的位置______________________,试剂A可以选用_____________________,试剂C可选用_______________________;
(2)步骤①的离子方程式_________________________________________;
(3)用电子式表示氯化镁的形成过程_______________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_____________________________________________________;
(5)戴维制镁的化学方程式为_____________________________________;
(6)配平下列反应的方程式。
① ?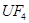 ?+ ?
?+ ?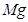 ?—— ?
?—— ?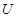 ?+ ?
?+ ?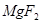
② ?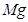 ?+ ?
?+ ?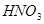 —— ?
—— ?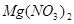 ?+ ?
?+ ?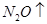 ?+ ?
?+ ?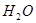
参考答案:(16分,每空2分)(1) 第三周期第ⅡA族, Ca(OH)2溶液 盐酸
(2) 2OH- + Mg2+= Mg(OH)2↓
(3) 
(4) MgCl2(熔融)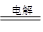 Mg + Cl2↑ (5)2K + MgO
Mg + Cl2↑ (5)2K + MgO  ?K2O + Mg
?K2O + Mg
(6) 1,2,1,2? 4,10,4,1,5
本题解析:(1)镁的原子序数是12,位于元素周期表的第三周期第ⅡA族。海水中的镁离子转化沉淀,应该加入石灰乳氢氧化钙,将镁离子转化为氢氧化镁沉淀。氢氧化镁转化为氯化镁,需要将氢氧化镁溶解在盐酸中。
(2)根据以上分析可知,步骤①的离子方程式是2OH- + Mg2+=Mg(OH)2↓。
(3)氯化镁是含有离子键的离子化合物,其形成过程可表示为
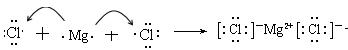 。
。
(4)在通电的条件下,电解熔融的氯化镁生成氯气和金属镁,反应的方程式是MgCl2(熔融)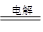 Mg + Cl2↑。
Mg + Cl2↑。
(5)在高温下,金属K和氧化镁发生置换反应,生成金属镁,反应的化学方程式是2K + MgO 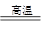 ?K2O + Mg。
?K2O + Mg。
(6)①在反应中Mg的化合价从0价升高到+2价,失去2个电子。U元素的化合价从+4价降低到0价,得到4个电子,所以根据电子的得失守恒可知,配平后的方程式是?1 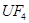 ?+ ?2
?+ ?2 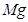 ?= 1
?= 1 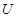 ?+ ?2
?+ ?2 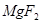 。
。
②根据方程式可知,Mg的化合价从0价升高到+2价,失去2个电子。硝酸中氮元素的化合价从+5价降低到+1价,得到4个电子,则根据电子的得失守恒可知,配平后的方程式是 4 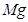 ?+ ?10
?+ ?10 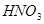 = ?4
= ?4 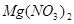 ?+ ?1
?+ ?1 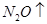 ?+ ?5
?+ ?5 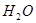 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以海水的综合应用为载体,有利于调动学生的学习兴趣,激发学生的学习求知欲。
本题难度:一般
2、填空题 (14分)
A—F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
元素
| 结构或性质
|
A
| 原子最外层电子数是内层电子总数的1/5
|
B
| 形成化合物种类最多的元素,其单质为固体
|
C
| 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5
|
D
| 地壳中含量最多的元素
|
E
| 与D同主族
|
F
| 与E同周期,且最外层电子数等于电子层数
|
请回答下列问题:
(1)A在元素周期表中的位置是?;A与E形成的化合物的电子式是?。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是?。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是?。
(4)F的盐酸盐水溶液呈酸性,原因是?(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是?。
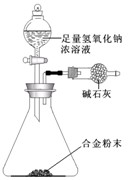
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和上图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b。
a是?;b是?。
②合金中A元素的质量分数是?(用含m、a、b的式子表示)。
参考答案:(1)第3周期,ⅡA族?
(2)2Fe3+ + Cu ="=" 2Fe2+ + Cu2+?(3)C + H2O 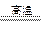 ?CO + H2?
?CO + H2?
(4)Al3+ + 3H2O  ?Al(OH)3 + 3H+?
?Al(OH)3 + 3H+?
2Al + Fe2O3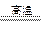 ?2Fe + Al2O3?
?2Fe + Al2O3?
(5)①反应前装置和药品的总质量?反应后装置和药品的总质量
②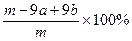
本题解析:略
本题难度:简单
3、选择题 短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是(?)
A.一定条件下,B单质能置换出D单质,C单质能置换出A单质
B.D元素处于元素周期表中第3周期第IV族
C.B的最高价氧化物中,B与氧原子之间为非极性共价键
D.四种元素的原子半径:A>B>D>C
参考答案:A
本题解析:略
本题难度:简单
4、选择题 放射性同位素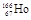 的原子核内中子数与电子数之差是
的原子核内中子数与电子数之差是
A.32
B.67
C.99
D.166
参考答案:A
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。又因为质子数+中字数=质量数,质子数=核外电子数,所以放射性同位素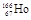 的原子核内中子数与电子数之差=166-67-67=32,答案选A。
的原子核内中子数与电子数之差=166-67-67=32,答案选A。
本题难度:简单
5、选择题 在一定条件下,RO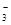 与R-可发生反应:RO
与R-可发生反应:RO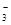 +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
A.元素R位于周期表中第ⅤA族
B.RO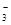 中的R只能被还原
中的R只能被还原
C.CaR2是离子化合物,阴阳离子电子层结构相同,且既含有离子键,又含有共价键
D.3 mol R2中,氧化产物与还原产物的质量比为5︰1
参考答案:D
本题解析:A.由于元素R形成的简单离子是R-。说明R一种的最外层有7个电子,因此位于周期表中第ⅦA族.错误。B.在RO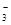 中的R的化合价为+5价,处于该元素的中间价态,所以既能被氧化,也能被还原。错误。C.R是第ⅦA族元素,CaR2是离子化合物,若R是Cl,则阴阳离子电子层结构相同,若R是Br, 则阴阳离子电子层结构不相同。在化合物中只含有离子键,不含有共价键。错误。D.在上述反应方程式中,根据电子守恒可知:每产生3 mol R2,氧化产物与还原产物的质量比为5︰1。正确。
中的R的化合价为+5价,处于该元素的中间价态,所以既能被氧化,也能被还原。错误。C.R是第ⅦA族元素,CaR2是离子化合物,若R是Cl,则阴阳离子电子层结构相同,若R是Br, 则阴阳离子电子层结构不相同。在化合物中只含有离子键,不含有共价键。错误。D.在上述反应方程式中,根据电子守恒可知:每产生3 mol R2,氧化产物与还原产物的质量比为5︰1。正确。
本题难度:一般