1、选择题 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是(?)
A.四种元素的氢化物中,Y的氢化物沸点最高
B.Z的单质不溶于水,有多种同素异形体
C.阴离子的还原性:X< Y
D. X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐
参考答案:C
本题解析:考查元素周期表的结构和元素周期律的应用。Y原子的最外层电子数是次外层电子数的3倍,所以Y只能是O,则根据元素在周期表中的位置可知X是N、Z是S、W是Cl。水分子中存在氢键,沸点最高。硫有多种同素异形体,其单质不溶于水。氨气和硝酸反应生成硝酸铵。非金属性是O大于N,所以阴离子的还原性是X>Y,因此正确的答案是C。
本题难度:一般
2、填空题 合金是建筑航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置是?。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为??。
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为?。焊接过程中使用的保护气为?(填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为?。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为?。
(3)航母螺旋浆主要用铜合金制造。
①80.0gCu-Al合金用酸完全溶解后,加入过量氨水,过滤得到白色沉淀39.0,则合金中Cu的质量分数为?。
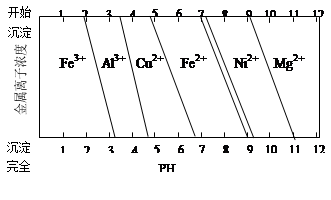
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合如图信息推断该合金中除铜外一定含有?。
参考答案:(14分)
(1)① 第三周期第Ⅲ族,CO2
② Al2O3+2NaOH=2NaAlO2+H2O,Ar(其它合理答案均可得分)
(2)① 吸氧腐蚀 ② CaCO3或CaO
(3)① 83.1% ② Al、Ni
本题解析:
(1)①铝土矿中的Al2O3与NaOH反应生成NaAlO2,通入CO2可生成氢氧化铝。
②Al2O3与NaOH反应生成NaAlO2和H2O;为防止合金被氧化,需要加惰性气体,如Ar等。
(2)①海水为中性,舰体中的钢发生吸氧腐蚀。
②CaO能与生铁中的SiO2反应生成CaSiO3和CO2,从而降低生铁中硅的含量。
(3)①白色沉淀为Al(OH)3,可得Cu的质量分数为:(80.0g-27 g?mol?1×39.0g/78 g?mol?1)/80.0g×100%= 83.1%
②根据题目所给图可以看出,Al3+在pH=3.4时开始转化为沉淀,说明合金中含Al,在pH为7.0、8.0时过滤沉淀,说明pH7.0到8.0范围内生成沉淀,根据图可以看出Ni2+在这个范围内转化为沉淀,说明合金中含Ni。
【考点定位】本题考查元素周期表、金属的腐蚀、化学方程式的书写、质量分数的计算、金属的冶炼和物质成分的判断。
本题难度:一般
3、选择题 现有下列短周期元素性质的数据:
?元素编号
元素性质
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
|
原子半径
| 0.74
| 1.60
| 1.52
| 1.10
| 0.99
| 1.86
| 0.75
|
最高化合价
| ?
| +2
| +1
| +5
| +7
| +1
| +5
|
最低化合物
| -2
| ?
| ?
| -3
| -1
| ?
| -3
|
下列说法正确的是(?)
A. 第一电离能:① > ⑦? B. 电负性:② < ④
C. 相应离子的半径: ② >⑥> ①
D. 气态氢化物的稳定性和沸点:⑦﹤④
参考答案:B
本题解析:根据原子半径和最高最低化合价可以判断①是O;②是Mg;③是Li;④是P;⑤是Cl;⑥是Na;⑦是N;
A:N原子属于半充满状态,故第一电离能氮大于氧
B:镁为活泼金属,而P为非金属,电负性磷大于镁
C:三者离子的核外电子排布相同,核电荷数越大,离子半径越小,即:① >⑥> ②
D:N元素的非金属性强于P,故NH3稳定性强于与PH3;由于氨气分子间有氢键,故其沸点也相对较高
故答案为B
本题难度:一般
4、选择题 已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析正确的是
A.与镓同主族且相邻周期的元素,其原子序数为23或49
B.与镓同周期且相邻主族的元素,其原子序数为30或32
C.原子半径:Br>Ga> Cl> Al
D.碱性:KOH>Ga(OH)3>Al(OH)3
参考答案:D
本题解析:A、镓(31Ga)是第四周期第ⅢA族元素,与镓同主族且相邻周期的元素,原子序数相差18,故为13或49,故A错误;B、镓(31Ga)是第四周期第ⅢA族元素,同周期ⅣA与之相邻,原子序数为32,与第ⅡA不相邻,故B错误;C、同周期自左而右原子半径逐渐减小,故原子半径Ga>Br、Al>Cl,故C错误;D、同周期自左而右金属性逐渐减弱,同主族自上而下金属性逐渐增强,故金属性K>Ga>Al。金属性越强最高价氧化物对应水化物的碱性越强,故碱性KOH>Ga(OH)3>Al(OH)3,故D正确,答案选D。
本题难度:一般
5、填空题 A、B、C、D是短周期的四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。试回答:
(1)A原子的电子式为?,B元素能形成的两种同素异形体的物质的化学式为?,C元素的离子结构示意图为?。
(2)化合物E中所含有的化学键是?,它属于?化合物。
(3)写出A、B两元素形成的化合物与E反应的化学方程式:?。
(4)写出D的最高价氧化物的水化物和A单质反应的化学方程式:?。
此反应中氧化产物与还原产物的物质的量之比为?。
参考答案:(1)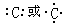 ,O2 ?O3,?
,O2 ?O3,?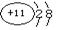 ?
?
(2)共价键、离子键,(只写1个不给分);离子化合物
(3)2Na2O2+CO2=2Na2CO3+O2?
(4)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O? 1:2
CO2↑+2SO2↑+2H2O? 1:2
本题解析:A、B、C、D是短周期的四种元素,原子序数依次增大,A原子的最外层上有4个电子,则A为碳;A原子的最外层上有4个电子,说明A是ⅣA元素,又因为A的原子序数是四种元素中序数最小的,所以A只能C元素。B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E,可推得B为氧,C为钠,E为过氧化钠。D的L层电子数等于K、M两个电子层上的电子数之和。因此D是S元素。(1)碳原子的电子式为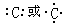 ,B元素能形成的两种同素异形体的物质的化学式为O2 ?O3, C元素的离子结构示意图为
,B元素能形成的两种同素异形体的物质的化学式为O2 ?O3, C元素的离子结构示意图为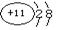 。 (2)过氧化钠中含有的化学键是?共价键、离子键,它属于离子化合物。(3)反应的化学方程式:2Na2O2+CO2=2Na2CO3+O2?。(4)碳和浓硫酸化学方程式:C+2H2SO4(浓)
。 (2)过氧化钠中含有的化学键是?共价键、离子键,它属于离子化合物。(3)反应的化学方程式:2Na2O2+CO2=2Na2CO3+O2?。(4)碳和浓硫酸化学方程式:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O?。此反应中氧化产物是二氧化碳与还原产物二氧化硫的物质的量之比为1:2。
CO2↑+2SO2↑+2H2O?。此反应中氧化产物是二氧化碳与还原产物二氧化硫的物质的量之比为1:2。
本题难度:一般