1、填空题 某元素的同位素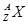 ,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的
,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的
AgNO3溶液20ml恰好完全反应,若这种同位素原子核内有20个中子,求:
(1)A=?
(2)X元素在周期表中的位置??,XCl2的化学式:?。
参考答案:(3分 )(1)40;(2)第四周期第IIA主族;CaCl2
本题解析:(1)硝酸银的物质的量是2mol/L×0.02L=0.04mol
则根据方程式Ag++Cl-=AgCl↓可知
氯化物中氯离子的物质的量是0.04mol
则该氯化物的物质的量是0.02mol
则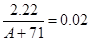
解得A=40
(2)Z=40-20=20
因此X是Ca,位于第四周期第ⅡA族
该氯化物的化学式是CaCl2
点评:该题是基础性试题的考查,难度不大。试题注重基础知识的巩固和解题方法的指导,有利于培养学生的逻辑思维能力和规范答题能力。
本题难度:一般
2、选择题 元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
A.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱
B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.第ⅠA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈
D.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新
参考答案:C
本题解析:同一主族,随着原子序数递增,非金属性逐渐减弱,气态氢化物的热稳定性逐渐减弱,气态氢化物的还原性逐渐增强,A项正确;同一周期从左到右元素非金属性逐渐增强,则B项正确;根据金属活动性顺序表知Ca比Na的金属性更强,所以和水反应更剧烈,C项错误。
本题难度:一般
3、选择题 下列描述的一定是金属元素的是
A.易失去电子的物质
B.原子核内有11个质子的元素
C.原子的最外电子层只有1个电子的元素
D.能与酸反应的物质
参考答案:B
本题解析:易失去电子,只能说明还原性强,但不一定是金属。选项B中质子数为11,则一定是钠元素,属于金属。C中也可能是氢元素。和酸反应的物质不一定是金属,所以答案选B。
本题难度:简单
4、选择题 A元素原子的M层比B元素原子的M层少3个电子,B元素原子核外电子数比A元素原子核外电子总数多5个,则A、B两元素形成的化合物可表示为
A.? BA2?B.? BA3? C.? A3B2? D.? B3A2
参考答案:D
本题解析:考查元素原子的电子排布规律。根据题意可判断,B元素原子核外M层已经排满,所以A元素的原子序数是15,即是P元素。则B的原子序数是20,是Ca元素。P的最低化合价是-3价,Ca的最高价是+2价,所以二者形成的化合物是Ca3P2,所以正确的答案是D。
本题难度:一般
5、选择题 从原子序数11依次增加到17,下列所述递变关系中,错误的是
A.最高正化合价数值逐渐增大
B.原子半径逐渐减小
C.电子层数逐渐增多
D.从硅到氯,最低负化合价从-4到-1
参考答案:C
本题解析:原子序数11依次增加到17属于第三周期的元素。同周期自左向右电子层数相同,原子半径逐渐减小,非金属性逐渐增强,金属性逐渐较弱,最高价氧化物的水化物的酸性逐渐增强,碱性逐渐较弱,所以选项C不正确,其余选项都是正确的,答案选C。
点评:该题是基础性试题的考查,也是高考中的常见考点。试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用元素周期律知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般