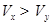1、选择题 有常温下物质的量浓度均为0.1 mol/L的①氨水②NH4Cl溶液③Na2CO3溶液?④NaHCO3溶液,下列说法正确的是(?)
A.4种溶液pH的大小顺序:①>④>③>②
B.等体积的①和②溶液混合后若pH>7:c(Cl-)>c(N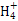 )
)
C.溶液①、③由水电离产生的c(OH-):①<③
D.溶液③、④等体积混合后,溶液中c(C )>c(HC
)>c(HC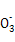 )
)
参考答案:C
本题解析:Na2CO3水解程度大于NaHCO3,碱性强,故4种溶液pH的大小顺序:①>③>④>②,A错;根据溶液电中性:c(N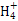 )+c(H+)=c(Cl-)+c(OH-),由溶液的pH>7,可知c(H+)<c(OH-),故c(N
)+c(H+)=c(Cl-)+c(OH-),由溶液的pH>7,可知c(H+)<c(OH-),故c(N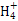 )>c(Cl-),B错;Na2CO3水解促进水的电离,NH3·H2O电离抑制水的电离,故水电离产生的c(OH-):①<③,C对;③、④等体积混合后以C
)>c(Cl-),B错;Na2CO3水解促进水的电离,NH3·H2O电离抑制水的电离,故水电离产生的c(OH-):①<③,C对;③、④等体积混合后以C 的水解为主,且C
的水解为主,且C 水解生成HC
水解生成HC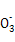 ,故溶液③、④等体积混合后,溶液中c(C
,故溶液③、④等体积混合后,溶液中c(C )<c(HC
)<c(HC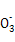 ),D错。
),D错。
本题难度:一般
2、选择题 有0.1mol?L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
A.溶液①中,c(CH3COO-)=c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)=c(H+),故A错误;
B.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,浓度越小,醋酸根离子浓度越小,所以混合液中c(CH3COO-)小于溶液③中的c(CH3COO-),故B错误;
C.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=c(Na+),故C正确;
D.溶液①、③等体积混合,醋酸的电离程度大于醋酸根离子水解程度,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液(c=0.1mol/L)至pH =7,消耗NaOH溶液的体积为 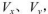 ,则
,则
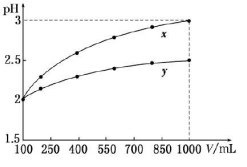
A.x为弱酸,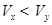
B.y为弱酸,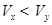
C.x为强酸,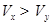
D.y为弱酸,