1、选择题 下列物质组合中,既能和强酸反应又能和强碱反应的是( )
①Al?②AlCl3?③Al(OH)3?④NaHCO3.
A.①②③④
B.②③④
C.①③④
D.①②④
参考答案:①金属铝与酸反应生成Al3+和氢气,与碱反应生成AlO2-和氢气,故①正确;
②AlCl3属于盐,能与碱反应,但不与强酸反应,故②错误;
③Al(OH)3 属于两性氢氧化物,既能与酸反应,生成Al3+离子,又能与碱反应生成AlO2-离子,故③正确;
④NaHCO3属于弱酸弱碱盐,既能与酸反应,生成CO2气体,又能与碱反应,生成盐,故④正确.
故选C.
本题解析:
本题难度:简单
2、选择题 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是

[? ]
A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
参考答案:D
本题解析:
本题难度:一般
3、选择题 将物质的量相等的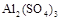 和
和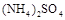 溶于水,形成VL混合溶液,向该混合溶液中逐滴加入某NaOH溶液直至过量。下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(Y)的关系的是
溶于水,形成VL混合溶液,向该混合溶液中逐滴加入某NaOH溶液直至过量。下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(Y)的关系的是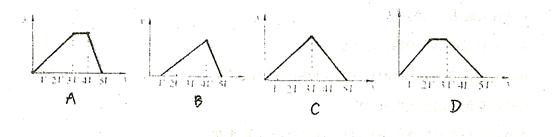
参考答案:A
本题解析:先比较NH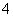 与Al3+结合OH-的能力:若NH
与Al3+结合OH-的能力:若NH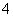 先与OH-结合,则生成的NH3·H2O还是能与Al3+结合释放出NH
先与OH-结合,则生成的NH3·H2O还是能与Al3+结合释放出NH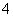 ,故结合OH-的顺序为:先Al3+,后NH
,故结合OH-的顺序为:先Al3+,后NH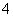 。再分析Al(OH)3与NH
。再分析Al(OH)3与NH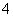 结合OH-的能力:若Al(OH)3先与OH-结合,则生成的AlO
结合OH-的能力:若Al(OH)3先与OH-结合,则生成的AlO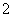 会与NH
会与NH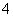 发生双水解反应:NH
发生双水解反应:NH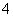 +AlO
+AlO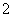 +H2O===Al(OH)3↓+NH3↑,又生成Al(OH)3沉淀,故结合OH-的顺序为:先NH
+H2O===Al(OH)3↓+NH3↑,又生成Al(OH)3沉淀,故结合OH-的顺序为:先NH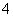 ,后Al(OH)3。当NH
,后Al(OH)3。当NH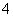 完全变为NH3·H2O后,随NaOH溶液的加入,Al(OH)3沉淀开始溶解至全部消失。因此各阶段反应的顺序为①Al3++3OH-===Al(OH)3↓,②NH
完全变为NH3·H2O后,随NaOH溶液的加入,Al(OH)3沉淀开始溶解至全部消失。因此各阶段反应的顺序为①Al3++3OH-===Al(OH)3↓,②NH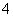 +OH-===NH3·H2O,③Al(OH)3+OH-===AlO
+OH-===NH3·H2O,③Al(OH)3+OH-===AlO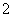 +2H2O。并注意生成Al(OH)3沉淀与沉淀溶解,消耗NaOH的体积比为3∶1。答案:A
+2H2O。并注意生成Al(OH)3沉淀与沉淀溶解,消耗NaOH的体积比为3∶1。答案:A
本题难度:一般
4、选择题 下图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是(?)

A.NH4Al(SO4)2
B.KAl(SO4)2
C.Al2(SO4)3
D.NaAlO2
参考答案:C
本题解析:氢氧化钡从1mol到3mol,沉淀粉的量呈现直线上升,表明成正比例关系,因此只能是硫酸铝了,选C。
本题难度:一般
5、填空题 铝可以制成铝箔是利用了铝的____________性;铝比铁不容易生锈的原因是铝表面较易形成__________。工业上可用铁槽车运输浓硫酸,是由于常温下浓硫酸能使铁_________。铁与水蒸气反应的化学方程式为__________________________。
参考答案:延展性;致密氧化膜。钝化。3Fe+4H2O Fe3O4+4H2(2分)。
Fe3O4+4H2(2分)。
本题解析:物质的结构决定物质的性质,物质的性质决定物质的用途;铝在常温下易与氧气反应,表面形成致密的氧化物薄膜,阻止内层的铝进一步被氧化,所以铝制品“不生锈”;由于常温下,铝遇浓硫酸,浓硝酸时会在表面生成致密的氧化膜而钝化,从而阻止内部金属进一步发生反应,铁与水蒸气在高温条件下反应生成Fe3O4和氢气,方程式为3Fe+4H2O(g) Fe3O4+4H2↑。
Fe3O4+4H2↑。
本题难度:一般