1、填空题 同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水。请完成下列问题:
(1)根据以上条件一定能判断出的元素有几种,请在下列横线上写出相应的元素符号:
A._____________,B._____________,C._____________,
D._____________,E._____________,F._____________。
(2)已知D单质在F单质中燃烧可能生成两种化合物,请分别写出生成两种化合物的化学方程式: ____________________________________;____________________________________。
(3)若1 mol F的最高价氧化物对应水化物与C的最高价氧化物对应水化物恰好完全反应,则等物质的量的C的最高价氧化物与A的最高价氧化物对应水化物反应消耗_____________mol A的最高价氧化物对应水化物。
参考答案:(1)Na? Mg? Al? P? S? Cl? (2)2P+3Cl2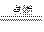 2PCl3? 2P+5Cl2
2PCl3? 2P+5Cl2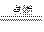 2PCl5? (3)
2PCl5? (3)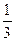
本题解析:(1)A、C、E三种元素的最高价氧化物对应的水化物之间两者皆反应生成盐和水,那么其中两种最高价氧化物对应水化物应为酸和碱,而另外一种水化物既能与酸反应,又能与碱反应,必为两性氧化物,中学范围内只有Al2O3了。又知A、B、C、D、E、F同周期,且原子序数依次增大,则C应为Al,A为金属,F为非金属,C之前的A、B应依次为Na、Mg。A、C、F最外层电子数共为11,则F最外层电子数为11-1-3=7,所以F应为Cl元素。
(2)D在周期表中位置在Al、Cl之间,可能为Si、P,不可能为S,因为E的序数大于D小于F,那么在Cl2中燃烧生成两种产物的应为P。
3Cl2+2P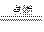 2PCl3
2PCl3
2P+5Cl2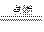 2PCl5
2PCl5
(3)A、F最高价氧化物对应水化物分别为NaOH、HClO4,与C最高价氧化物对应水化物Al(OH)3的反应分别为:
NaOH+Al(OH)3====NaAlO2+2H2O
3HClO4+Al(OH)3====Al(ClO4)3+3H2O
若HCl为1 mol,则Al(OH)3为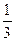 mol,消耗NaOH
mol,消耗NaOH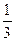 mol。
mol。
本题难度:简单
2、选择题 下列物质属于纯净物的是
A.漂白粉
B.水玻璃
C.纯碱
D.陶瓷
参考答案:C
本题解析:
本题难度:简单
3、填空题 如图所示,已知(1)甲、乙、丁均是前三周期元素的双原子单质。(2)在一定的条件下甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y,在产物中元素甲呈现负价。(3)在一定条件下乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈现负价。请完成下列问题:
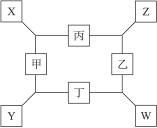
(1)甲:_________________,乙:______________。
(2)甲与丙反应生成X的反应的化学方程式:____________________________________。
(3)乙与丁反应生成W的反应的化学方程式:____________________________________。
参考答案:(1)N2? O2?(2)N2+3Mg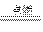 Mg3N2?(3)O2+2H2
Mg3N2?(3)O2+2H2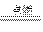 2H2O
2H2O
本题解析:由(1)可知前三周期可形成的双原子单质有N2、H2、F2、Cl2、O2。
由(2)在一定的条件下按物质的量之比为1∶3反应,前三周期的有:N2和H2、N2和Mg等,其中符合题意的为:N2和Mg。
由(3)同理分析在一定的条件下按物质的量之比为1∶2反应,且符合题意的为:O2和H2
综上可推断:甲为N2;乙为O2;丙为Mg;丁为H2;X为Mg3N2;Y为NH3;W为H2O;Z为MgO。
本题难度:简单
4、选择题 浊液区别于其他分散系最本质的特征是
A.外观混浊不清
B.分散质粒子不能透过半透膜
C.不稳定
D.分散质粒子直径大于100 nm
参考答案:D
本题解析:现象都是由分散质粒子直径大小这一本质引起的.
本题难度:简单
5、选择题 决定主族元素在元素周期表中所处位置的是该元素原子的
A.质量数
B.中子数
C.最外层电子数
D.电子层数和最外层电子数
参考答案:D
本题解析:由于主族序数=最外层电子数、周期数=电子层数,所以决定主族元素在元素周期表中所处位置的是该元素原子的电子层数和最外层电子数,答案选D。
点评:该题是基础性试题的考查,主要是考查学生对元素周期表编制原则的了解掌握情况,旨在巩固学生的基础,提高学生的应试能力。
本题难度:简单