1、实验题 (15分)I.(9分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
?实验方案
| ?实验现象
|
①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞
| (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色
|
②向新制的H2S饱和溶液中滴加新制的氯水
| (B)产生气体,可在空气中燃烧,溶液变成浅红色
|
③钠与滴有酚酞试液的冷水反应
| (C)反应不十分强烈,产生的气体可以在空气中燃烧
|
④镁带与2 mol·L-1的盐酸反应
| (D)剧烈反应,产生可燃性气体
|
⑤铝条与2 mol·L-1的盐酸反应
| (E) 生成淡黄色沉淀
|
请你帮助该同学整理并完成实验报告:
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律。
(2)实验用品:
仪器:①试管?②酒精灯?③胶头滴管?④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸?⑨烧杯等。
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、饱和的H2S溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
①?②?③?④?⑤?(用A-E表示)
写出③的离子方程式?。
(4)实验结论:?。
II. (6分)实验室利用如图装置进行中和热的测定,请回答下列问题:
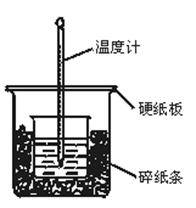
(1)从实验装置上看,图中尚缺少一种玻璃仪器是?。
(2)做1次完整的中和热测定实验,温度计需使用?次。
(3)某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么??
2、填空题 己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:
(1)YW2的电子式?;Z的氢化物结构式为?;写出U元素在周期表中的位置?。
(2)原子半径:U?V(填>、<或=,下同);气态氢化物的水溶液的酸性:U?V。
(3)写出UW2与V元素的单质在水溶液中反应的化学方程式是?。
(4)由X、Z组成的一种化合物化学式为ZX5,其各原子均达到同周期稀有气体原子的稳定结构,该物质属于?(填“离子”或“共价”)化合物。
(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为:?。
3、计算题 (9分)将主族元素X的最高价氧化物X2O 4.7 g溶于95.3 g水中,所得溶液中溶质的质量分数为5.6%。Y与X在周期表中位于同一主族,Y的氢氧化物12 g与400 mL 0.75 moL·L-1的盐酸恰好中和。Z与Y在周期表中位于同一周期,标准状况下5.6 L ZO2气体的质量为16 g。求X、Y、Z的相对原子质量。并分别写出它们原子的电子式。
4、选择题 下列物质性质的变化规律中与共价键键能大小有关的是
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高;②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅;④NaF、NaCl、NaBr、NaI熔点依次降低
A.仅③
B.①③
C.②④
D.②③
5、填空题 (10分)
⑴微粒AXn-核外有18个电子,则它的核电荷数为?,核内中子数为?。
⑵由1H216O与2H217O所代表的物质中,共有?种元素,?种原子,
16O、17O的关系为?。(填同位素或同种原子或同种核素)