1、选择题 关于1s、2s、3s、4s原子轨道的说法,正确的是
A.电子只能在电子云轮廓图中运动
B.能级不同,电子云轮廓图形状相同
C.轨道数目相同,电子云轮廓图形状、大小完全相同
D.能层不同,电子云轮廓图形状也不相同
参考答案:B
本题解析:A、电子在电子云轮廓图外出现的概率小,错误;B、都是s轨道,电子云轮廓图形状相同为球形,故B项正确,D项错误;C、大小不同,1s、2s、3s、4s逐渐变大,错误。
本题难度:简单
2、选择题 分类方法对化学学科的发展起到了非常重要的作用.下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据是否含有氧原子,酸可分为含氧酸和非含氧酸
A.①③
B.②③
C.①②
D.①
参考答案:B
本题解析:一元酸、二元酸的分类标准是根据酸电离出的H+个数,①不正确;故答案为B项.
本题难度:简单
3、填空题 (1)元素周期表有______个周期,每一周期中元素原子的_______________相同,从左到右元素的金属性_________(填增强或减弱);元素周期表中有________列,第ⅥA族处在第_________列,同一主族从上到下,元素的非金属性依次_________(填增强或减弱)。
(2)下列物质中:互为同素异形体的有??(填序号,下同),属于同位素的有?,属于同一种物质的有?,属于同分异构体的有?。
①液氯?②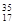 Cl ?③白磷?④氯气?⑤红磷?
Cl ?③白磷?④氯气?⑤红磷?
⑥ Cl?⑦正丁烷?⑧异丁烷
Cl?⑦正丁烷?⑧异丁烷
参考答案:(1)7,?电子层数, 减弱,? 18,? 16,?减弱? (2) ③⑤,②⑥?,①④?,⑦⑧
本题解析:(1)根据元素周期表的结构和元素周期律可知,元素周期表有7个周期,每一周期中元素原子的电子层数相同,从左到右元素的金属性逐渐减弱;元素周期表中有18列,第ⅥA族处在第16列,同一主族从上到下,元素的非金属性依次逐渐减弱。
(2)由同一种元素形成的不同单质,互称为同素异形体,则互为同素异形体的是③⑤;质子数相同而中子数不同的同一种元素的不同核素互为同位素,所以互为同位素的是②⑥;性质和结构都完全相同的属于同一种物质,则①④种两种物质是同一种物质;分子式相同而结构不同的化合物互为同分异构体,所以⑦⑧中两种物质互为同分异构体。
点评:该题是基础性试题的考查,也是高考中的常见考点。试题难易适中,基础性强,侧重对学生基础知识的巩固与训练,有利于培养学生运用基础知识解决实际问题的能力。该题的关键是明确元素周期表的结构几种概念的含义,特别是概念的内涵和外延,以及判断依据,有利于调动学生的学习兴趣和学习积极性。
本题难度:一般
4、填空题 (18分)下表是元素周期表的一部分,回答下列有关问题:(用元素符号或化学式填空)
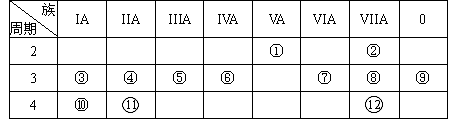
(1)写出下列元素符号:①________,⑥________,⑦________。
(2)画出原子的结构示意图:④________,⑤________,⑧________。
(3)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________。
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。
(5)在③与④中,化学性质较活泼的是________,怎样用化学实验证明:答:________
在⑧与⑿中,化学性质较活泼的是________,怎样用化学实验证明?答:____________。(用化学反应方程式表示)
参考答案:(1)①N;⑥Si;⑦S;(2) ;
;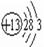 ;
;
(3)K;F;Ar?(4)HClO4;KOH;Al(OH)3;
(5)Na;与H2O反应;? Cl2;Cl2+2NaBr=2NaCl+Br2
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断①~?分别为N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br。根据元素周期律可知同周期自左向右非金属性逐渐增强,金属性逐渐减弱。同主族自上而下金属性逐渐增强,非金属性逐渐减弱。所以①~?金属性最强的是K,非金属性最强的是F。稀有气体的最外层电子已经达到稳定结构,所以性质最不活泼。金属性越强,最高价氧化物的水化物的碱性越强。非金属性越强,最高价氧化物的水化物的酸性越强。所以酸性最强的是HClO4,碱性最强的是KOH,两性的是Al(OH)3。比较元素的金属性强弱可以利用金属单质和水或酸反应的剧烈程度,或者是相互之间的置换能力等。比较元素的非金属性强弱,也可以利用单质之间的相互置换能力,或者与氢气化合的难易程度以及相应氢化物的稳定性等。
本题难度:一般
5、选择题 下图中a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是
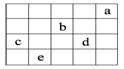
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素的性质最稳定
C.相同条件下b和d气态氢化物溶于水,溶液的酸性:d<b
D.e元素最高价氧化物的水化物和不同量的氧氧化钠溶液反应,可能生成三种盐
参考答案:D
本题解析:由图可知,a为He元素;b为O元素;c为Si元素;d为CL元素;e为As元素;
A错,O元素有—2、—1、0价;B错,五种元素中,He元素性质最稳定;C错,O的氢化物为H2O,CL的氢化物为HCL;水为中性,HCL溶液为酸性;
D正确,As的最高价氧化物的水化物为H3AsO4,属于三元弱酸;
本题难度:一般