1、选择题 在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原混和液中K+的物质的浓度为
A.0.2mol/L
B.0.25mol/L
C.0.45mol/L
D.0.225mol/L
参考答案:C
本题解析:分析:Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,根据硫酸根守恒,此时溶液中c(SO42-)= ×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=
×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)= ×0.2mol/L×
×0.2mol/L× =0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-),原混合溶液中为反应后溶液中c(K+)的二倍.
=0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-),原混合溶液中为反应后溶液中c(K+)的二倍.
解答:Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,根据硫酸根守恒,此时溶液中c(SO42-)= ×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=
×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)= ×0.2mol/L×
×0.2mol/L× =0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-)=0.025mol/L+2×0.1mol/L=0.225mol/L,所以原混合溶液中为反应后溶液中c(K+)为0.225mol/L×2=0.45mol/L.
=0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-)=0.025mol/L+2×0.1mol/L=0.225mol/L,所以原混合溶液中为反应后溶液中c(K+)为0.225mol/L×2=0.45mol/L.
故选:C.
点评:本题考查有关混合物的计算,题目浓度不大,注意根据质量守恒和电荷守恒的角度解答.
本题难度:困难
2、选择题 某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是
A.反应前后,溶液中离子浓度基本保持不变的只有Na+
B.有一种沉淀和两种气体产生
C.反应前后溶液颜色不发生变化
D.溶液中共发生了3个氧化还原反应
参考答案:A
本题解析:分析:某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体.
解答:某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体.
A.通过以上分析知,没有参加反应的离子是钠离子,所以反应前后,溶液中离子浓度基本保持不变的只有Na+,故A正确;
B.通过以上分析知,有一种沉淀和一种气体生成,故B错误;
C.通过以上分析知,反应前溶液呈无色,反应后有溴单质生成,溴水呈橙色,所以溶液由无色变为橙色,故C错误;
D.共发生了氯气氧化SO32-、Br-2个氧化还原反应,故D错误;
故选A.
点评:本题考查了氯水成分和离子反应的判断,明确氯气的氧化性、氯水中盐酸的作用是解答的关键,难度较大.
本题难度:简单
3、选择题 NA表示阿伏加德罗常数的值,下列说法中正确的是
A.100mL?lmol?L-1Na2CO3溶液中溶质离子的总数为0.3NA
B.若120g的墨粉(只含碳)能打a个字,则平均每个字约含有个碳原子
C.25℃、l01?kPa时,0.1NA个H2分子完全燃烧生成液态水,放出akJ热量,表示氢气燃烧热的热化学方程式为△H=+1OakJ?mol-1
D.常温下28g14CO中含有14NA个电子
参考答案:B
本题解析:分析:A、碳酸根离子水解;
B、120g的墨粉(只含碳)能打a个字,一个字需要墨粉的质量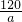 ,碳原子数=
,碳原子数= =
=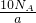 ;
;
C、氢气燃烧热是放热反应,焓变为负值;
D、质量换算物质的量,结合质子数+中子数=质量数计算电子数.
解答:A、100mL?lmol?L-1Na2CO3溶液中溶质离子的总数小于0.3NA,故A错误;
B、120g的墨粉(只含碳)能打a个字,一个字需要墨粉的质量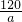 ,碳原子数=
,碳原子数= =
=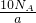 ;则平均每个字约含有
;则平均每个字约含有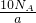 个碳原子,故B正确;
个碳原子,故B正确;
C、表示氢气燃烧热的热化学方程式为H2(g)+ O2(g)=H2O(l)△H=-1OakJ?mol-1 ,故C错误;
O2(g)=H2O(l)△H=-1OakJ?mol-1 ,故C错误;
D、常温下28g14CO物质的量为 ,小于1mol,含有的电子数小于14NA,故D错误;
,小于1mol,含有的电子数小于14NA,故D错误;
故选B.
点评:本题考查阿伏伽德罗常的应用,主要是盐类水解应用,质量换算物质的量计算微粒数,热化学方程式判断,题目难度中等.
本题难度:简单
4、选择题 取一小块钠放在燃烧匙里加热,下列实验现象描述正确的是
① 钠先熔化?②燃烧放出黄色火花?③燃烧后得到白色固体?④燃烧时火焰为黄色?⑤燃烧后得到浅黄色固体
A.①②
B.①②③
C.①④⑤
D.①③④
参考答案:C
本题解析:试题分析:钠的熔点较低,受热易熔化。同时钠极易被氧化,加热时燃烧发出黄色的火焰,同时生成淡黄色的过氧化钠,因此正确的答案选C。
考点:考查钠燃烧的有关实验现象
点评:化学是以实验为基础的一门学科,所以准确观察并描述实验现象,也是学生必须具备的一种能力,本题难度不大,较易得分。
本题难度:困难
5、选择题 设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是
A.1?mol甲烷中的氢原子被氯原子完全取代,需要2?nA?Cl2
B.1.5?mol?NO2与足量H2O反应,转移的电子数为2nA
C.常温常压下,46?g的NO2和N2O4混合气体含有的原子数为3nA
D.常温常压下,mg乙烯与mg丙烯中均含有()nA对共用电子对
参考答案:CD
本题解析:分析:A、取代反应的特征是有出有进,有机化合物中的氢原子被其他原子或原子团代替发生的反应;1mol氢原子需要1molCl2取代;
B、根据化学方程式计算电子转移数;
C、二氧化氮和四氧化二氮的组成元素相同,原子个数比相同,所以只需要计算46gNO2中 所含原子数即可;
D、质量换算物质的量,结合分子结构计算共价键物质的量,形成一个共价键需要两个电子;
解答:A、1?mol甲烷中含有4mol氢原子,4molCl2提供4mol氯原子发生取代反应,被氯原子完全取代,需要4?nA?Cl2,故A错误;
B、NO2与足量H2O反应的化学方程式为:3NO2+H2O=2HNO3+NO,每3molNO2反应转移电子物质的量为2mol,所以1.5?mol?NO2与足量H2O反应,转移的电子数为nA,故B错误;
C、NO2和N2O4的最简比相同,只需计算46gNO2中所含原子物质的量即可,46?g的NO2和N2O4混合气体含有的原子数为=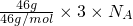 =3nA,故C正确;
=3nA,故C正确;
D、mg乙烯C2H4含有共价键即共用电子对物质的量=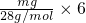 =
=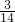 mol,mg丙烯C3H6中含有共价键即共用电子对物质的量=
mol,mg丙烯C3H6中含有共价键即共用电子对物质的量=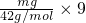 =
=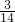 mol,所以,mg乙烯与mg丙烯中均含有(
mol,所以,mg乙烯与mg丙烯中均含有(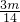 )nA对共用电子对,故D正确;
)nA对共用电子对,故D正确;
故选CD.
点评:本题考查了阿伏伽德罗常数的应用,氧化还原反应的电子转移数的计算,主要考查依据物质的量计算微粒数、共价键、共用电子对数的计算关系.
本题难度:困难