1、填空题 (10分)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为? ▲?。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为? ▲?。该工艺选择氯气的优点是? ▲?。(答一点即可)
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为10-3 mol/L,则理论上生成的SO42-为? ▲?mol/L。
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4+ + 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。可取甲醛b mL于锥形瓶,加入1滴酚酞,用浓度为C mol/L的NaOH溶液中和,滴定管的初始读数V1 mL,当溶液呈微红色时,滴定管的读数V2 mL。
②向其中加入饱和食盐水试样a mL,静置1分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3 mL。
则饱和食盐水中的含氮量为? ▲?mg/L。
参考答案:(1)HClO (2分)
(2)3Cl2 + 2NH4++ 8OH- = N2↑ + 6Cl- + 8H2O。(2分)
利用氯碱工业的产品氯气为原料,就近取材;不引入其他杂质离子。(2分)
(3)5×10-4(2分)
(4)14000C(V3—V2)/a mg/L (2分)
本题解析:略
本题难度:一般
2、实验题 (5分)现有A、B两种金属分别与盐酸反应,产生氢气的速率相近。请设计一个原电池实验证明A、B两种金属的活动性。
参考答案:将A、B两种金属片用导线连接放入盐酸中组成原电池,有气泡逸出的是较不活泼的金属,另一极即是活泼的金属。
本题解析:当活动性不同的金属组成原电池时,相对活泼金属失电子,在相对不活泼金属上氢离子得电子,析出氢气。
本题难度:简单
3、实验题 某校化学兴趣小组设计了如下实验装置(图中部分夹持仪器已略去)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。

请回答下列问题:
(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现彖,其原因是①_____②_____
(2)点燃酒精灯,可观察到B中的现象是_____________________,C 的作用是___________________
(3)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为________________(写表达式)。
(4)兴趣小组使用设计的如图实验装置,操作正确,且每一个反应均完全,仍然发现所测得的铁碳合金中铁的质量分数偏低,其主要原因是________________。
(5)若反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
I:只含有Fe3+; II:只含有Fe2+;III:________________________
验证III的实验方法是________________________
参考答案:
(1)常温下碳与浓硫酸不反应,常温下Fe遇浓硫酸发生钝化
(2)品红溶液褪色,或“颜色变浅”;除尽反应产物中的SO2气体
(3)(11m-3b)/11m
(4)干燥管中的碱石灰吸收了空气中的二氧化碳、水蒸气等
(5)既有Fe2+又有Fe3+
取试样少许于试管中,先滴加少量的KSCN溶液,振荡后溶液显红色证明有Fe3+;再取试样少许于另一支试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+。
本题解析:(1)常温下,碳与浓硫酸不反应,Fe遇浓硫酸发生钝化,因此无明显现象。
(2)点燃酒精灯后,反应开始,碳与浓硫酸反应可生成CO2和SO2,Fe与浓硫酸反应生成SO2,B装置检验SO2,现象是品红褪色,C装置除尽SO2,D装置干燥气体,E装置吸收CO2。
(3)E增重的是CO2的质量,bgCO2中C的质量为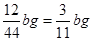 ,因此Fe的质量分数为
,因此Fe的质量分数为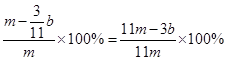 。
。
(4)该实验的原理是通过测量CO2的量计算铁的质量分数,CO2的质量通过干燥管E的实验前后质量差获得,干燥管右侧直接通空气,则空气中的CO2、水蒸气都可能进入干燥管中,使CO2的质量偏大,铁的质量分数偏小。
(5)结合前两种可能,则第三种是既有Fe2+又有Fe3+。检验Fe3+一般用KSCN,现象是溶液显红色,检验Fe2+一般利用其还原性,用酸性KMnO4溶液检验,现象是浅红色褪去。
本题难度:困难
4、实验题 在研究硝酸的性质时,某班学生做了如下三个实验:
实验一:试管中加入铜片和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
实验二:试管中加入铜片和稀硝酸(可适当加热),片刻后,塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
实验三:试管中加入红热的木炭和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
问:
(1)实验一中硝酸在反应中表现出__________ 性。
(2)实验二现象_______________。
(3)实验三中发生反应的化学方程式______________。
(4)将实验一产生的NO2气体和氧气的混合气体共10 mL充满量筒,倒立在盛有水的水槽中,充分反应后,最后剩余1 mL气体,问原混合气体中NO2和O2的体积分别为_______ mL、______ mL或_____ mL、______mL
参考答案:(1)氧化性,酸性?
(2)溶液变蓝色,产生无色气泡,试管口气体变红棕色,固体溶解
(3)C + 4HNO3 → CO2 + 4NO2↑ + 2H2O
(4)7.2mL; 2.8 mL ;8.6 mL ;1.4 mL
本题解析:
本题难度:一般
5、实验题 已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2),某小组同学设计了如图所示装置(夹持仪器和连接用的胶管已经省略)。
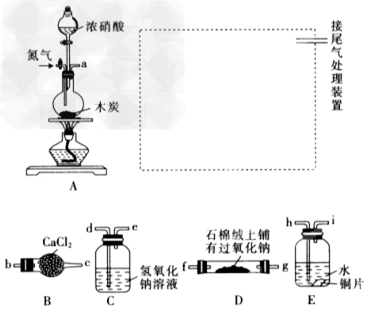
(1)①为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为a?→(?)(?)→?(?)(?)→?(?)?(?)→?(?)(?)(填仪器接口的字母编号)。
②连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通入氮气的主要目的是________________________。
(2)装置E中观察到的主要实验现象有_______________。
(3)装置C的作用是__________________。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成:_______________(写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I-氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式:___________________。
参考答案:(1)hi→de→bc→fg(或gf);排除装置中的空气,防止一氧化氮被空气中的氧气氧化为二氧化氮
(2)溶液由无色变成蓝色,有无色气体逸出
(3)除去一氧化氮中的二氧化碳
(4)取少量D中的固体于试管中,加入稀硫酸,若溶液中有气泡产生且在试管液面上方变成红棕色气体,则D中有亚硝酸钠生成(或其他合理答案)
(5)2NO2+2I-+4H+=2NO+I2+2H2O
本题解析:
本题难度:一般