1、简答题 某研究性学习小组将实验室制备二氧化碳气体反应后的废物进行处理,目的是制取中性干燥剂CaCl2.得到固体后,他们对固体的成分进行了如下探究:
[提出猜想]
猜想一:只有CaCl2
猜想二:CaCl2和CaCO3
猜想三:CaCl2和HCl
通过讨论,大家认为“猜想三”不成立,理由是______.
[实验探究]
| 操作 | 现象 | 结论
步骤一
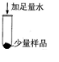
______ |
猜想二成立
步骤二

______
|
(1)写出有关反应的化学方程式:______
(2)实验结束后,同学们根据复分解反应发生的条件,总结出得到CaCl2的不同途径,如:
①Ca(OH)2+YCla﹦CaCl2+Z↓,那么Z可能是______(填一种物质的化学式即可);
②CaXm+2YClb﹦CaCl2+H2O,则“YClb”属于______类物质.
(3)同学们又用类比的方法对CaCl2可能具有的化学性质进行了探究,总结出其能与下列物质中的______发生反应(填编号).
①HNO3?②AgNO3?③Na2CO3?④Fe(OH)3?⑤Mg?⑥BaCO3.
2、选择题 下列实验操作中错误的是(? )?
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液蒸干
D.称量时,称量物放在称量纸上,置于天平左盘,砝码放在天平右盘中
3、实验题 某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol?L-1、0.001 mol?L-1,?催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol?L-1)的用量均为2mL。
(1)配平化学方程式:
______KMnO4 +____H2C2O4 +_____H2SO4 → ____K2SO4 +_____MnSO4 +_____CO2 +______H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号
| T/K
| 催化剂的用量/ g
| KMnO4酸性溶液的浓度/mol?L-1
| 实验目的
|
①
| 298
| 0.5
| 0.01
| (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响;
(Ⅱ)实验①和③探究温度对该反应速率的影响;
(Ⅲ)实验①和______探究催化剂对该反应速率的影响
|
②
| ?
| ?
| ?
|
③
| ?
| ?
| ?
|
④
| ?
| 0
| ?
|
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是________________
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是_______
A.硫酸钾? B.硫酸锰? C.二氧化锰? D.水
(4)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液
的浓度?/?mol?L-1
| 溶液褪色所需时间?t / min
|
第1次
| 第2次
| 第3次
|
0.01
| 14
| 13
| 11
|
0.001
| 6
| 7
| 7
|
计算用0.001?mol?L-1?KMnO4酸性溶液进行实验时KMnO4的平均反应速率?(忽略混合前后溶液体积的变化)。
(4)?若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?_________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案_____________________________________
4、实验题 某化学科外活动小组所做实验如图所示:图中→表示气流方向,M是纯净干燥的气体,Y是另一种气体,E内有红棕色气体产生,实验所用药品只能在下列物质中选用:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、NH4HCO3碱石灰、蒸馏水。
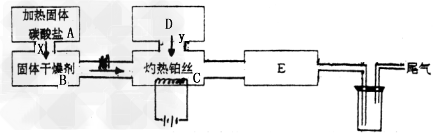
填写下列空白:
(1)A中所用装置的主要仪器有:___________________。
(2)B中选用的干燥剂是_________,其作用是_______________。
(3)C中发生的主要化学方程式为____________________ 。
(4)D中制取Y的化学方程式为____________________ 。
5、选择题 选用实验装置完成对应的实验,能达到目的的是
