1、计算题 (10分)已知几种共价键的键能数据如下:
共价键
| N≡N
| H-H
| N-H
|
键能/(kJ·mol-1)
| 946
| 436
| 390.8
|
⑴通过计算,写出合成氨反应的热化学方程式。
⑵某温度下,以1 mol N2和3mol H2作为初始反应物,在体积为2 L的恒容密闭容器中进行合成氨反应,达到平衡时测得反应放热68.1 kJ,试计算N2的转化率和该温度下的化学平衡常数。
2、选择题 温度一定时, 于密闭容器中发生可逆反应: mA(气) + nB(气)  pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是(?)
pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是(?)
A.平衡向逆反应方向移动
B.C气体的体积分数增大
C.气体A的转化率升高
D.m + n > p
3、填空题 工业合成氨反应:N2+3H2 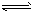 ?2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1mol N三N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
?2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1mol N三N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可_________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是_______________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol/L/min。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
4、选择题 在体积固定的密闭容器中通入各为1mol的A、C、D和x mol B,发生反应:A(g)+4B(g)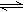 2C(g)+D(g)。当x在一定范围内变化时,均可以通过调节反应器的温度,使反应达到平衡时保持容器中气体总物质的量为5mol。若使起始反应向正反应方向进行,则x的取值范围下列适合的是(?)
2C(g)+D(g)。当x在一定范围内变化时,均可以通过调节反应器的温度,使反应达到平衡时保持容器中气体总物质的量为5mol。若使起始反应向正反应方向进行,则x的取值范围下列适合的是(?)
A. 1<x<2? B. 2<x<4? C. 1<x<5? D. 2<x<5
5、选择题 下列说法可以证明反应N2 + 3H2 2NH3,已达平衡状态的是( )
2NH3,已达平衡状态的是( )
A.1个N≡N键断裂的同时有6个H-N键形成
B.1个N≡N键断裂的同时有3个H-H键形成
C.容器内各物质的浓度相等
D.容器内N2、H2、NH3的速率之比为1:3:2