1、选择题 在一定温度下,反应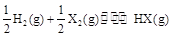 的平衡常数为10。若将
的平衡常数为10。若将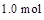 的
的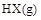 通人体积为1.0
通人体积为1.0 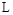 的密闭容器中,在该温度时的
的密闭容器中,在该温度时的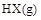 最大分解率接近于(?)
最大分解率接近于(?)
A.5%
B.17%
C.25%
D.33%
参考答案:B
本题解析:该温度达到平衡时的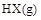 分解率最大,反应
分解率最大,反应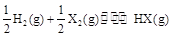 的平衡常数为10所以反应
的平衡常数为10所以反应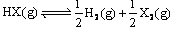 的平衡常数为
的平衡常数为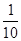 ?。
?。
设平衡时转化的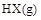 的物质的量为xmol,所以:
的物质的量为xmol,所以:
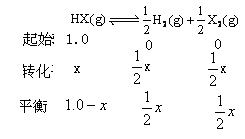
平衡常数为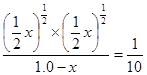 (体积为1L),解得:
(体积为1L),解得: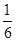 。所以最大分解率为
。所以最大分解率为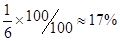 ,所以答案选B。
,所以答案选B。
本题难度:一般
2、计算题 在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s
浓度mol·L-1
| 0
| 20
| 40
| 60
| 80
| 100
|
c(N2O4)mol·L-1
| 0.100
| c1
| 0.050
| c3
| a
| b
|
c(NO2)/mol·L-1
| 0.000
| 0.060
| c2
| 0.120
| 0.120
| 0.120
|
试填空:
(1)达到平衡时N2O4的转化率为?%,表中c2?c3,a ?b (选填“>”“<”“=”)。
(2)20s的四氧化二氮的浓度c1=?mol·L-1,在0s~20s内四氧化二氮的平均反应速率为?mol·(L·s)-1;。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是?mol·L-1。
参考答案:(1)60,>,="?" (2)0.070,0.0015? (3)0.200
本题解析:略
本题难度:简单
3、选择题 在高温下,反应2HBr(g) H2(g) + Br2(g)(△H>0)达到平衡时,要使混合气体的颜色变浅,且使Br2的百分含量保持不变,可采取的方法是(?)
H2(g) + Br2(g)(△H>0)达到平衡时,要使混合气体的颜色变浅,且使Br2的百分含量保持不变,可采取的方法是(?)
A.增大体积
B.增大压强
C.降低温度
D.保持体积不变增加氢气
参考答案:A
本题解析:要使混合气体的颜色变浅,则单质溴的浓度移动减小。又因为Br2的百分含量保持不变,所以根据方程式可知,改变的条件是降低压强,即选项A是正确,其余选项平衡都发生移动,答案选A。
本题难度:一般
4、填空题 (8分)在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2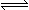 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
 (1)2min内,平均反应速率v(O2)=?; v(SO3)=?。
(1)2min内,平均反应速率v(O2)=?; v(SO3)=?。
 (2)2min时,SO2的浓度为?
(2)2min时,SO2的浓度为?
 (3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
?
参考答案:(1)0.1mol/(L·min)、0.2mol/(L·min)?(2)1.1mol/L
(3)2SO2(g)+O2(g) 2SO3(g)? △H=-2.5QkJ/mol
2SO3(g)? △H=-2.5QkJ/mol
本题解析:(1)反应速率通常用单位时间内浓度的变化量来表示,所以氧气的反应速率为 。因为速率之比是相应的化学计量数之比,所以SO2的反应速率是氧气的2倍,即为0.2mol/(L·min)。
。因为速率之比是相应的化学计量数之比,所以SO2的反应速率是氧气的2倍,即为0.2mol/(L·min)。
(2)根据(1)可知2min内消耗0.4mol氧气,则必然消耗0.8molSO2,所以SO2的浓度为 。
。
(3)根据(1)可知2min内消耗0.4mol氧气,放出的热量是Q kJ,则消耗1mol氧气放出的热量是2.5kJ,所以热化学方程式为2SO2(g)+O2(g) 2SO3(g)? △H=-2.5QkJ/mol。
2SO3(g)? △H=-2.5QkJ/mol。
本题难度:一般
5、填空题 (8分)钾是—种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l)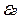 NaCl(l)+K(g)(正反应吸热)
NaCl(l)+K(g)(正反应吸热)
压强(kPa)
| 13.33
| 53.32
| 101.3
|
K的沸点(℃)
| 590
| 710
| 770
|
Ka的沸点(℃)
| 700
| 830
| 890
|
KCl的沸点(℃)
| ?
| ?
| 1437
|
NaCl的沸点(℃)
| ?
| ?
| 1465
|
该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见上表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为?,而反应的最高温度应低于?。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是?。
(3)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为:K= ?。
?。
参考答案:(1)770℃? 890℃ (2)降低压强或移去钾蒸气?适当升高温度?(3)K=c(K)/c(Na)
本题解析:略
本题难度:一般