1、填空题 铝是一种重要的金属,在生产、生活中具有许多重要的用途。眉山市电解铝厂位于三苏故里修文乡,现已经形成年产33万吨电解铝,配套年产15万吨阳级碳块的规模。该厂用铝土矿为原料制备铝的工艺流程如下

已知:
①铝土矿的主要成分是?Al2O3,此外还含有少量CuO、Fe2O3等杂质。?
②电解冶炼铝时用碳棒作阳极,用Na3AlF6作助熔剂,电解熔融的Al2O3。
回答下列问题:?
(1)写出铝土矿与?A?溶液反应的化学方程式?________________。
(2)滤渣?C的主要成分为___________;实验室过滤时使用的玻璃仪器有___________。
(3)生成过程中,除CaO、H2O可以循环使用外,还可以循环使用的物质有________?(填化学式)。
(4)写出过量CO2通入滤液C生成D的离子方程式?___________________。
(5)若生产54吨铝,放出平均摩尔质量为36g/mol的气体(经测定气体中不含O2),则消耗阳极______吨。
参考答案:(1)Al2O3+2NaOH=2NaAlO2+H2O
(2)CuO、Fe2O3;烧杯、漏斗、玻璃棒
(3)CaCO3、CO2、NaOH?
(4)CO2+AlO2-+2H2O?=?Al(OH)3↓+HCO3-
(5)24
本题解析:
本题难度:一般
2、填空题 β-锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含 有FeO、CaO、MgO等。以β-锂辉石为原料制备碳酸锂的一种流程如下:?
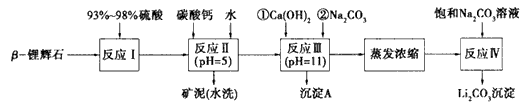
已知:
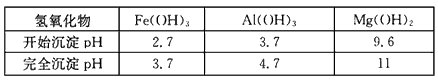
①部分金属氢氧化物开始沉淀和完全沉淀的pH:
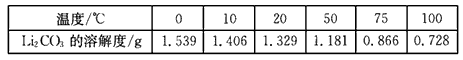
②Li2CO3在不同温度的溶解度如下表:
回答下列问题:
(1)反应Ⅱ中加碳酸钙的作用是____。
(2)写出反应Ⅲ中生成沉淀A的离子方程式___、____。
(3)写出反应Ⅳ的化学方程式___。洗涤所得Li2CO3沉淀要用热水而非冷水,原因是____。
参考答案:(1)除去反应I中过量的H2SO4,控制pH使Fe3+ 、 Al3+完全沉淀
(2)Mg2+ +2OH-=Mg(OH)2↓? ;Ca2++CO32- = CaCO3↓
(3) Li2SO4+Na2CO3=Li2CO3↓+Na2SO4? ;Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗
本题解析:
本题难度:一般
3、填空题 氢溴酸在医药和石化工业上有广泛甩途。下图是模拟工业制备氢溴酸粗品并精制的流程

根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为________________
(2)混合①中使用冰水的目的是_______________
(3)操作Ⅱ和操作Ⅲ的名称分别是_________________操作Ⅲ一般适用于分离________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是________________
参考答案:(1)SO2+Br2+2H2O=2HBr+H2SO4
(2)降低体系温度,防止溴蒸发,使反应完全
(3)过滤、蒸馏;d
(4)除去粗品中未反应完的溴
本题解析:
本题难度:一般
4、选择题 下列物质的用途说法不正确的是
[? ]
A.利用铝热反应焊接铁轨?
B.苏打是治疗胃酸过多的一种药剂
C.明矾可用于净水?
D.镁合金密度小,硬度和强度大,可用于制造飞机的部件?
参考答案:B
本题解析:
本题难度:简单
5、填空题 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:

已知:
①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:?
2Na2SiO3+2NaAlO2+4H2O===Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)写出Al2O3与NaOH溶液反应的化学方程式:____________。
(2)滤渣A的主要成分________;实验室过滤时使用玻璃棒,其作用是________。
(3)若该工厂用?kg铝土矿共制得?kg?Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为______。
(4)若将铝溶解,下列试剂中最好选用_______(填编号)。
A.浓硫酸 B.?稀硫酸 C.稀HNO3? D.浓HNO3
理由是______________________
参考答案:“略”
本题解析:
本题难度:一般