1、填空题 四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备
TiCl4等产品的一种工艺流程示意如下
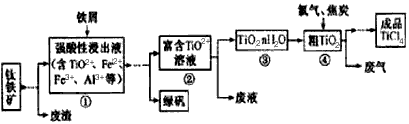
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe == 3Fe2+
2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O === TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·nH2O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+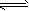 Fe3++H2O的平衡常数K=___________。
Fe3++H2O的平衡常数K=___________。
(4)已知:TiO2(s) +2Cl2(g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=== 2CO(g) △H=-221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用_____________方法。

2、填空题 硫酸铜在工农业生产中有着广泛的应用,用某种氧化铜矿制备硫酸铜的工艺流程如下
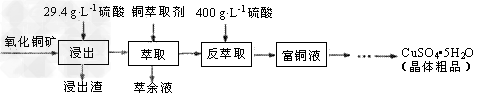
(1)浸出时所用硫酸的质量浓度(单位体积的溶液所含溶质的质量)为29.4g·L-1,其物质的量浓度是_____,浸出过程中反应的化学方程式是___________________。
(2)萃取“相比”是表示萃取效果的参数之一,指的是有机相(O)与水相(A)的体积比。采用一定浓度的铜萃取剂萃取硫酸浸出液中的铜离子,测得当萃取时间为120s时, “相比”(O/A)对铜萃取率的影响如图所示。在实际操作中“相比”应选择_______?。(填序号)
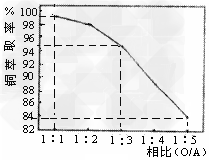
A.1:1?B.1:3?C.1:5
(3)已知铜萃取剂可用HR(O)表示,萃取过程可表示为:Cu2++2HR(O) CuR2(O)+2H+,反萃?取加入400?g/L?硫酸的理由是________________。
CuR2(O)+2H+,反萃?取加入400?g/L?硫酸的理由是________________。
(4)从富铜液中获得较多晶体粗品的实验操作依次是________、________(填操作名称)过滤、干燥。
(5)游泳场馆常用硫酸铜作杀菌剂,这是利用了CuSO4的?_________性质。
3、填空题 某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下:
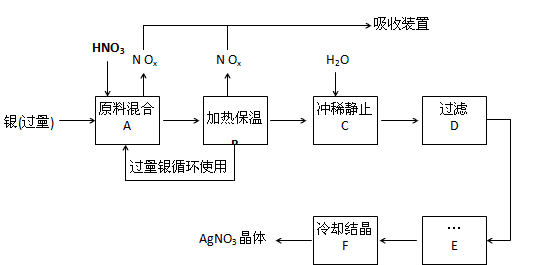
(1)工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。
(2)步骤B加热保温的作用是__________ :
a. 有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
(3)步骤C是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是____________ ;
(4)步骤C中加水的量应该适量,若加入过多的水,对后续步骤造成的不良影响是:_____________ ;
(5)步骤E进行的操作是______________ 。
(6)制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使
Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反应的化学方程式为:_______________ 。
4、填空题 金属钛素有“太空金属”“未来金属”“海洋金属”等美誉,已知钛的化合价主要有+4价和+3价,其中
+3价钛极易被氧化;有关氢氧化物开始沉淀的pH 如下
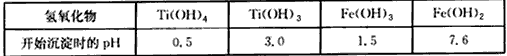
某地钛铁矿主要成分为FeTiO3,含有少量杂质SiO2等;提纯TiO2并得到副产品FeSO4·7H2O(绿矾)的工艺流程如下

回答下列问题:
(1)黑钛液中生成的主要阳离子有TiO2-和Fe2+,写出反应①的化学方程式:_____________________
(2)黑钛液中加入铁粉的主要目的是____________;
(3)步骤④的离子方程式是____________________;
(4)钛的冶炼新法是电解法。OS法电解炼钛示意图:
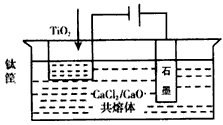
以CaCl2/CaO共熔体作为介质,电解时,在阴极生成的Ca进一步还原TiO2得钛。写出阴极生成钛的有关电极反应式和化学方程式:_______________________
5、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~5.0,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,起目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③_______________________ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有____________________ 。
②计算上述样品中CaCl2·2H2O的质量分数为________________ 。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有______________;______________________ 。