1、填空题 [化学——选修3: 物质结构与性质](15分)
Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为?。
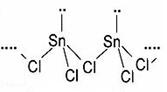
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出
所含有的配位键。其固体分子及气体分子中Sn的杂化方式为??。
(3)SnCl4分子的空间构型为?,SnCl4与CCl4中
沸点较高的是?。
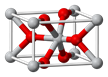
(4)锡的某种氧化物的晶胞如右图,其化学式为?。
(5)解释白锡分子的密度大于灰锡的密度的原因:?。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度?为?。
2、选择题 下列各组元素中,第一电离能依次减小的是(?)
A.H Li Na K
B.Na Mg Al Cl
C.I Br Cl F
D.F O N C
3、填空题 (每空1分?共10分) A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: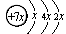 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(2) D的氢化物比C的氢化物的沸点_____(填"高"或"低"),原因____________。
(3)E元素在周期表的位置是?。
(4)画出D的核外电子排布图_________________________________________,这样排布遵循了?原理、____________原理和____________规则。
(5)用电子式表示B的硫化物的形成过程:______________________________。
4、选择题 X、Y、Z三种元素,已知X和Y元素的原子核外电子层数相同,Y和Z元素的原子最外层电子数相同.三种元素原子最外层电子数总和为14,而质子数总和为28,则这三种元素为
A.N、P、O?B.N、C、Si
C.B、Mg、Al?D.C、N、P
5、选择题 已知X、Y、Z为同周期的短周期元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是
A.原子序数:Z>Y>X
B.最外层电子数:Z>Y>X ?
C.原子半径:X>Y>Z?
D.气态氢化物的稳定性:HX>H2Y>ZH3