1、填空题 [化学——选修3: 物质结构与性质](15分)
Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为?。
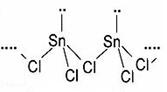
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出
所含有的配位键。其固体分子及气体分子中Sn的杂化方式为??。
(3)SnCl4分子的空间构型为?,SnCl4与CCl4中
沸点较高的是?。
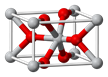
(4)锡的某种氧化物的晶胞如右图,其化学式为?。
(5)解释白锡分子的密度大于灰锡的密度的原因:?。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度?为?。
参考答案:(1)5s25p2(2分)
(2)?图略 (2分) sp3、、 sp2(各1分)
(3)正四面体;SnCl4(各1分)
(4)SnO2(2分)
(5)配位数大,空间利用率大(2分)
(6)952/NA(a×10—10)3(3分)
本题解析:(1)Sn元素是50号元素,最外层电子是4个,位于元素周期表的第五周期,第四主族,所以价层电子排布式为5s25p2;
(2)Sn元素的5p轨道上有空轨道,Cl原子中有孤对电子,所以1个SnCl2分子中的Sn与另一分子中的Cl原子可以形成配位键,从而形成一维链状聚合结构,配位键的形式是从提供孤对电子的一方指向提供空轨道的一方;固体分子SnCl2中存在一个配位键,所以Sn的价层电子对数是3+1/2(4-2×1)=4,所以是sp3杂化;气态时以单分子形式存在,所以Sn的价层电子对数是2+1/2(4-2×1)=3, sp2杂化;
(3)SnCl4分子中Sn的价层电子对数是4+1/2(4-4×1)=4,空间构型是正四面体型;SnCl4与CCl4都是分子晶体,所以相对分子质量大的分子间作用力大,沸点较高,所以SnCl4的沸点较高;
(4)锡的某种氧化物的晶胞中Sn原子8顶点各1个和中心1个,共是8×1/8+1=2个,O原子分别在上下2个底面各2个和体内的2个,共是4×1/2+2=4,所以Sn与O的原子个数比是2:4=1:2,化学式为SnO2
(5)白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似,配位数是4,所以白锡晶体的配位数大,空间利用率大,单位体积拥有的Sn原子多,密度大;
(6)灰锡晶胞中Sn原子的个数是8,与金刚石晶胞中C原子个数相同,所以灰锡的密度=m/V=8×119/NA/(a×10-10)3=952/NA(a×10—10)3g/cm3
本题难度:一般
2、选择题 下列各组元素中,第一电离能依次减小的是(?)
A.H Li Na K
B.Na Mg Al Cl
C.I Br Cl F
D.F O N C
参考答案:A
本题解析:金属性越强,第一电离能越小,属于答案选A。
本题难度:一般
3、填空题 (每空1分?共10分) A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: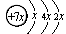 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(2) D的氢化物比C的氢化物的沸点_____(填"高"或"低"),原因____________。
(3)E元素在周期表的位置是?。
(4)画出D的核外电子排布图_________________________________________,这样排布遵循了?原理、____________原理和____________规则。
(5)用电子式表示B的硫化物的形成过程:______________________________。
参考答案:(每空1分,共10分) (1)F? F ?(2) 高?因为NH3分子间形成氢键?
(3)第周期第四Ⅷ族? (4)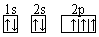 ;能量最低?泡利?洪特
;能量最低?泡利?洪特
(5) 
本题解析:考查元素周期表的结构及元素周期律的应用等。
根据元素的结构及有关性质可知,A、B、C、D、E分别是Si、Na、P、N、Fe。
(1)氮元素是第二周期元素,由于非金属性越强,第一电离能越大,而F是最强的非金属元素,所以第一电离能最大的是F。同样非金属性越强,电负性也是最大的,因此也是F。
(2)由于NH3分子间形成氢键,所以氨气的沸点高于PH3的。
(3)铁的原子序数是26,位于第四周期第Ⅷ族。
(4)考查原子核外电子的排布规律。根据构造原理可知,氮原子的核外电子排布图
 。因为这样这样排布遵循了能量最低原理,泡利原理和洪特规则。
。因为这样这样排布遵循了能量最低原理,泡利原理和洪特规则。
(5)钠和S形成的是离子化合物,其形成过程是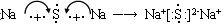 。
。
本题难度:一般
4、选择题 X、Y、Z三种元素,已知X和Y元素的原子核外电子层数相同,Y和Z元素的原子最外层电子数相同.三种元素原子最外层电子数总和为14,而质子数总和为28,则这三种元素为
A.N、P、O?B.N、C、Si
C.B、Mg、Al?D.C、N、P
参考答案:D
本题解析:X和Y原子核外电子层数相同,则二者同周期。Y和Z原子最外层电子数相同,则二者同主族。X、Y、Z三种元素最外层电子数之和为14,讨论推知:可以为6、4、4(即C、Si、O)或4、5、5(即C、N、P),结合质子数总和为28,可得D选项正确。
本题难度:一般
5、选择题 已知X、Y、Z为同周期的短周期元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是
A.原子序数:Z>Y>X
B.最外层电子数:Z>Y>X ?
C.原子半径:X>Y>Z?
D.气态氢化物的稳定性:HX>H2Y>ZH3
参考答案:D
本题解析:略
本题难度:简单