1、填空题 工业上利用电解饱和食盐水可制得重要化工产品。
(1)写出化学方程式并标出电子转移的方向和数目:
(2)氧化剂:
还原剂:
(3)每转移1mol电子,可得到 mol氯气;
利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t。
参考答案:(1)

(2)H2O NaCl (3)0.5 58.5
本题解析:(1)电解饱和食盐水生成氢气、氯气和氢氧化钠,是氯碱工业的基础,反应中氯失去电子被氧化,氢得电子被还原;(2)化合价降低了的反应物为氧化剂,化合价升高了的反应物为还原剂;(3)每转移1mol电子,可得到0.5mol氯气;NaCl---HCl ,盐酸的物质的量为100t×36.5%÷36.5×58.5=58.5t 。
考点:电解饱和食盐水、氧化还原反应
本题难度:一般
2、填空题 某同学利用MnO2、KClO3固体、AgNO3溶液、铜片四种物质及其反应产物完成了四种基本反应类型的实验,请写出有关反应的化学方程式:
①______
②______
③______
④______.
参考答案:(1)分解反应由一种物质反应生成两种物质的反应,满足该条件的,只有氯酸钾制氧,故答案为:分解反应为2KClO3催化剂.△2KCl+3O2↑;
(2)复分解反应由两种化合物相互交换成分形成两种新的化合物的反应,满足该条件的,只有氯化钾和硝酸银的反应,故答案为:复分解反应为KCl+AgNO3=AgCl↓+KNO3;
(3)化合反应由两种物质反应生成一种物质的反应,满足该条件的只有镁和氧气的反应,故答案为:化合反应为2Cu+O2?△?.?2CuO;
(4)置换反应由一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,满足该条件的只有镁和硝酸银的反应,故答案为:置换反应为Cu+2AgNO3=Cu(NO3)2+2Ag.
本题解析:
本题难度:一般
3、选择题 元素从化合物中被置换成单质时,该元素
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.既不被氧化,也不被还原
参考答案:C
本题解析:略
本题难度:简单
4、实验题 (16分)铁的单质和化合物在实验和实际生产中都有重要作用。
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
操作
| 现象
|
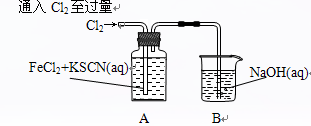
| 现象1:A中溶液变红
现象2:稍后,溶液由红色变为黄色
|
(1)B装置中反应的化学方程式____________ _ _______________ _______。
(2)A中溶液变红的原因是____________________ _ _________________________。
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_ _。
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+与SCN-生成红色Fe(SCN) 3的反应 可逆反应(是或不是)。
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为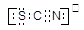 ,
,
离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 ;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为 个。
②若要检验产物中含有SO42-,常用的化学试剂是________(写试剂名称)。
Ⅱ.高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为______极,电极反应式为________________ __。
参考答案:Ⅰ. (1) 2NaOH + Cl2 =NaCl + NaClO + H2O (3分,没有配平扣1分)
(2)Fe2+ 被Cl2氧化产生Fe3+,Fe3+与SCN-反应生成Fe(SCN)3呈红色 (2分)
(3)① Fe3+ (2分);② 是(2分)
(4)① 8×6.02×1023 (2分,合理即得分,如写成8NA,但只写8不给分)
②氯化钡溶液、盐酸(2分,写化学式得0分)
Ⅱ.正(1分);FeO42-+3e-+3H2O=FeOOH+5OH-(2分,没有配平扣1分)
本题解析:试题分析:(1)为防止污染,B中氢氧化钠吸收多余氯气,其化学方程式为: 2NaOH + Cl2 =NaCl + NaClO + H2O(2)Cl2可氧化Fe2+生成Fe3+,Fe3+与SCN-反应生成Fe(SCN)3溶液,呈红色.(3)①取A中黄色溶液于试管中,加NaOH溶液,生成红褐色沉淀,说明有氢氧化铁固体生成,所以原溶液中一定存在Fe3+;另取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。实验说明,Fe3+与SCN-生成红色Fe(SCN) 3是可逆反应。(4)①、由SCN-的电子式为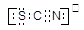 可S为-2价,C为+4价,N为-3价,所以在方程式SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 中,S元素与N元素被Cl2氧化,所以1mol反应转移16mole-,则0.5molSCN-被氧化时转移的电子总数为8×6.02×1023个。②、检验SO42-:加入盐酸酸化后再加BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有SO42-;II、已知:Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,可知在该电极Fe由+6价变为+3价,为正极,电极反应式为FeO42-+3e-+3H2O=FeOOH+5OH-。考点:了解常见金属及其重要化合物的主要性质及其应用。了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算。 了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
可S为-2价,C为+4价,N为-3价,所以在方程式SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 中,S元素与N元素被Cl2氧化,所以1mol反应转移16mole-,则0.5molSCN-被氧化时转移的电子总数为8×6.02×1023个。②、检验SO42-:加入盐酸酸化后再加BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有SO42-;II、已知:Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,可知在该电极Fe由+6价变为+3价,为正极,电极反应式为FeO42-+3e-+3H2O=FeOOH+5OH-。考点:了解常见金属及其重要化合物的主要性质及其应用。了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算。 了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题以铁的化合物的性质为载体综合考查了物质的检验,尾气处理,氧化还原反应的分析与相关计算,电化学电极反应分析与电极反应方程式的书写。
本题难度:困难
5、选择题 在反应中CaH2+2H2O=Ca(OH)2+2H2↑,下列叙述正确的是(?)
①H2是氧化产物 ②H2是还原产物?③H2是氧化产物又是还原产物④CaH2中氢元素既被氧化又被还原?⑤生成1mol H2时,电子转移1mol⑥H2O是氧化剂
A.②④⑤
B.③⑤⑥
C.①④⑥
D.②⑤⑥
参考答案:B
本题解析:略
本题难度:一般