1、选择题 下列化学反应中,为使平衡体系析出更多的银,可采取的措施是Ag++Fe2+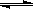 Ag(固)+Fe3+(正反应放热)
Ag(固)+Fe3+(正反应放热)
A常温下加压 B增加Fe3+的浓度
C增加Fe2+的浓度 D移去一些析出的银
参考答案:C
本题解析:略
本题难度:一般
2、实验题 一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)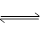 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)该反应的平衡常数表达式K=?;根据下图,升高温度,K值将?增大压强K值将?(填“增大”、“减小”或“不变”)。

(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是?(用nA 、nB、?tA 、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是?(填字母)。
a. v生成(CH3OH)= v消耗(CO)? b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变? d. CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是?(填字母)。
a. c(H2)减少? b正反应速率加快,逆反应速率减慢
c. CH3OH 的物质的量增加? d.重新平衡时c(H2)/ c(CH3OH)减小
参考答案:(1)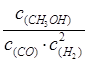 (2分)减小(1分)、不变(1分) (2)
(2分)减小(1分)、不变(1分) (2)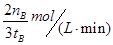 ?(2分) (3)cd(2分) (4)cd(2分)
?(2分) (3)cd(2分) (4)cd(2分)
本题解析::(1)①化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数表达式是K=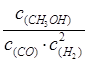 。
。
②根据图像可知,温度越高,甲醇的含量越低。说明升高温度,平衡想逆反应方向越低,即正反应是放热反应,K值减小
K值只与温度有关,加压时其值不变
(2)500℃时,在tB时达到平衡,CH3OH的物质的量为nB,以甲醇来表示的反应速率为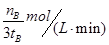 ,由反应系数之比可知,氢气的反应速率为
,由反应系数之比可知,氢气的反应速率为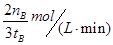
(3)判断该可逆反应达到化学平衡状态的标志是?(填字母)。
a. v生成(CH3OH)、v消耗(CO)均表示的为正反应速率,并不能说明正逆反应速率相等,排除
b.在恒容情况下,反应混合气体的质量为定值,密度必为定值,不能做为平衡的判定标志
c.混合气体的质量为定值,但总物质的量一直在改变,故当混合气体的平均相对分子质量不再改变时,平衡达到平衡状态,正确
d. 符合平衡状态的概念,正确
(4)300℃时,将容器的容积压缩到原来的1/2,各物质浓度均增大,正逆反应速率均增大;压强增大,平衡正向移动,CH3OH 的物质的量增加,H2的物质的量减小,重新平衡后,c(H2)/ c(CH3OH)减小
故选cd
本题难度:一般
3、选择题 在一定温度下,可逆反应A2(g)+B2(g)  2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A.A2、B2、AB的浓度不再变化
B.容器中的压强不再随时间变化而变化
C.A2、B2、AB的浓度之比为1:1:2
D.单位时间内生成n mol A2的同时生成2n molAB
参考答案:AD
本题解析:略
本题难度:简单
4、选择题 某温度下,反应N2 (g)+3H2 (g) 2NH3(g);△H <0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(H2)/c(NH3)与原平衡相比变小了,则改变条件的可能有
2NH3(g);△H <0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(H2)/c(NH3)与原平衡相比变小了,则改变条件的可能有
A.升高温度
B.增大N2浓度
C.减小压强
D.加入催化剂
参考答案:B
本题解析:正反应是放热反应,升高温度,平衡向逆反应方向移动,则c(H2)/c(NH3)与原平衡相比应该是变大,A不正确;增大N2浓度,平衡向正反应方向移动,则c(H2)/c(NH3)与原平衡相比应该是变小,B正确;正反应是就减小的,所以减小压强,平衡向逆反应方向移动,则c(H2)/c(NH3)与原平衡相比应该是变大,C不正确;催化剂不能改变平衡状态,比值不变,所以答案选B。
本题难度:一般
5、填空题 (16分)平衡指的是两个相反方向的变化最后所处的运动状态;在平衡时,两种变化仍在继续进行,但是它们的速率相等;根据变化的性质可分为物理平衡和化学平衡,中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:
A(g) + B(g)  ?C(g)?△H= - a kJ·mol-1
?C(g)?△H= - a kJ·mol-1
20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
①计算20s内B气体的平均化学反应速率为___________,写出该反应的平衡常数表达式___________。
②保持容器温度和容积不变,若改为向其中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = a?(B) Q1 + 2Q2 < 2a?(C)Q1 + 2Q2 > 2a?(D)Q1 + Q2 < a
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入b mol A气体(b>0)时,v(正)_____v(逆)(填“>”、“<”或“=”),重新达平衡后,C气体的平衡体积分数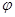 (C) =
(C) = 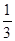 ,则b = ____________。
,则b = ____________。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值_____20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________________________。
②如果V=40.00,则此时溶液中c(OH-) - c(H+) - c(CH3COOH)= ___________________mol·L-1。
参考答案:(16分)
(1)①0.05mol/(L·s)(1分),K=c(C)/[c(A) ·c(B)](2分)。
②C(2分)。
③ >(2分),4/3或1.33(2分)。
(2)①<(2分),c(Na+) = c(CH3COO-) > c(H+) = c(OH-) (3分)。
② 1/30或0.033(2分)
本题解析:(1)根据A(g) + B(g)  ?C(g),生成1 mol C气体,则消耗1 mol B气体,
?C(g),生成1 mol C气体,则消耗1 mol B气体,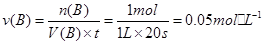 ,化学平衡常数即生成物的浓度与反应物浓度之比,不要忘记系数的次方,K=c(C)/[c(A) ·c(B)];2 mol A气体和2 mol B气体生成1 mol C气体,放出热量Q1kJ,加入1molC气体,则转化的C气体比0.5 mol要多,即吸收的热量比Q1/2大,所以Q1 + 2Q2 > 2a;增加反应物浓度,v(正)大于v(逆),设加入的b mol气体A转化了x mol,则
,化学平衡常数即生成物的浓度与反应物浓度之比,不要忘记系数的次方,K=c(C)/[c(A) ·c(B)];2 mol A气体和2 mol B气体生成1 mol C气体,放出热量Q1kJ,加入1molC气体,则转化的C气体比0.5 mol要多,即吸收的热量比Q1/2大,所以Q1 + 2Q2 > 2a;增加反应物浓度,v(正)大于v(逆),设加入的b mol气体A转化了x mol,则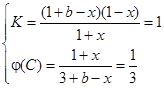 可以求出
可以求出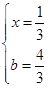
(2)可以假设氢氧化钠是20mL,此时恰好中和,溶液中只有醋酸钠,呈碱性,所以pH=7时,氢氧化钠体积小于20mL。根据溶液中的电荷守恒可知c(Na+) = c(CH3COO-) > c(H+) = c(OH-)。当V=40mL时,溶液中溶质是CH3COOH和CH3COONa;根据电荷守恒和物料守恒关系,可以推断:c(OH-) - c(H+) - c(CH3COOH)= c(Na+) =0.033 mol·L-1
点评:综合性强,难度较大。
本题难度:一般