1、简答题 草木灰中富含钾盐,主要成分是碳酸钾还含有少量氯化钾(其中还含有较多的不溶性固体杂质).现从草木灰中提取钾盐,并用检验其中的?CO32-、SO42-、和?Cl-.
(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品,②溶解沉降,③______,④______,⑤冷却结晶.
(2)在进行②、③、④操作时,都要用到玻璃棒,其作用分别是:②______;③______;④______.
(3)将制得的少量晶体放入试管,加热蒸馏水溶解并把溶液分成三份,分装3支试管里.
①在第一支试管里加入稀盐酸,可观察有______生成,证明溶液中有______离子.②在第二支试管里加入足量盐酸后,再加入?BaCl2?溶液,可观察到有______?生成,证明溶液中有______离子.
③在第三支试管里加入足量稀硝酸后,再加入?AgNO3?溶液,可观察到有______生成,证明溶液中有______?离子.
参考答案:解;(1)从草木灰中除去不溶性的固体杂质来提取固体碳酸钾的实验操作顺序为:称量样品;溶解、沉淀;过滤;蒸发结晶.故填:过滤,蒸发结晶.
(2)在实验操作过程中,玻璃棒的作用分别是:搅拌,加速样品溶解(助溶);引流,防止滤液溅到漏斗外;搅拌(匀热),使溶液受热均匀,防止滤液飞溅.
故答案为:搅拌,加速样品溶解(助溶);引流,防止滤液溅到漏斗外;搅拌(匀热),使溶液受热均匀,防止滤液飞溅.
(3)①碳酸根离子能和盐酸反应生成二氧化碳,向溶液中加入稀盐酸后有气泡生成说明有碳酸根离子;②向原溶液中滴加盐酸酸化的氯化钡溶液,排除了其它阴离子的干扰,如果产生白色沉淀,就说明溶液中有硫酸根离子;③向原溶液中滴加足量稀硝酸后,排除了其它离子的干扰,再加入?AgNO3?溶液,产生白色沉淀,说明溶液中有氯离子.
故答案为:①气泡;?CO32-?②白色沉淀;?SO42-?③白色沉淀;?Cl-
本题解析:
本题难度:一般
2、实验题 漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为:________________?__,漂白粉的有效成分为?。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2mol·L-1NaOH溶液、2mol·L-1HCl溶液、2mol·L-1HNO3溶液、0.5mol·L-1BaCl2溶液、0.01mol·L-1AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
实验步骤
| 预期现象与结论
|
步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。
| ?
|
步骤2:向沉淀加入适量2mol·L-1HCl溶液,将产生的气体通入?
?
| 现象:?
?
结论:?
|
步骤3:取滤液分装A、B两支试管。向A试管,?
?
| 现象:溶液先变红色,然后褪色。
结论:?
?
|
步骤4:向B试管,?
??
| 现象:产生白色沉淀。
结论:?
|
?
(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉bg加水溶解后配制成100mL溶液,准确量取25.00mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.1000mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00mL。则该漂白粉中Ca(ClO)2的质量分数为_____________?_。(只列算式,不做运算,已知:Mr[Ca(ClO)2]="143" ;Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
参考答案:(17分)
(1)2Ca(OH)2+2Cl2=CaCl2+ Ca(ClO)2+2H2O?(3分)? Ca(ClO)2(1分)
(2)
实验步骤
预期现象与结论
?
步骤2:适量澄清石灰水(1分)
现象:沉淀溶解(1分),产生的气体使石灰水变浑浊(产生沉淀),或石灰水先产生白色沉淀,后沉淀溶解)(1分)
结论:该漂白粉含有CaCO3。(1分)
?
步骤3:滴加2滴酚酞试液(1分)
结论:该漂白粉含有Ca(ClO)2,(1分)
可能含有Ca(OH)2。(1分)
步骤4:滴加过量2mol·L-1HNO3溶液(1分)和0.01mol·L-1AgNO3溶液(1分)
?
结论:该漂白粉含有CaCl2。(1分)
?
(说明:1、试剂用量不准确,整题合扣1分;? 2、其他合理即给分)
(3)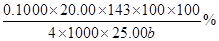 ?或
?或 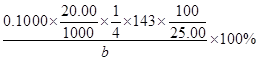
或 (3分,有效数字不准确,扣1分)
(3分,有效数字不准确,扣1分)
本题解析:(1)工业上用氯气和足量氢氧化钙反应制漂白粉,即2Ca(OH)2+2Cl2=CaCl2+ Ca(ClO)2+2H2O;漂白粉的有效成分是次氯酸钙,即Ca(ClO)2;(2)步骤2:若漂白粉变质,由于碳酸的酸性比次氯酸强,则次氯酸钙与空气中的CO2、H2O能发生复分解反应,即Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,因此漂白粉溶于水后所得沉淀可能是碳酸钙;盐酸的酸性比碳酸强,若沉淀溶于足量2mol/LHCl溶液,产生的气体能使足量澄清石灰水变浑浊,或者产生的气体先使澄清石灰水变浑浊,后又变澄清,说明漂白粉已经部分变质或完全变质,其中含有CaCO3;步骤3:酚酞先遇碱性溶液变红,后遇次氯酸盐溶液褪色,根据结论推断,向A管中加入几滴或少量酚酞溶液,振荡,溶液先变红后褪色的,说明该漂白粉部分变质,含有Ca(ClO)2,可能含有Ca(OH)2;步骤4:向B管中先滴入足量2mol/LHNO3溶液、后滴入少量0.01mol/LAgNO3溶液,产生白色沉淀,说明该漂白粉中含有CaCl2;(3)由于n=c?V,则每次滴定平均消耗0.1000×20.00×10—3molNa2S2O3;由于2Na2S2O3+I2=Na2S4O6+2NaI中各物质的系数之比等于物质的量之比,则与Na2S2O3反应的I2为0.1000×20.00×10—3/2mol;由于 Cl2+2KI=2KCl+I2中各物质的系数之比等于物质的量之比,则置换出I2需要0.1000×20.00×10—3/2mol Cl2;由于Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O中各物质的系数之比等于物质的量之比,则25.00mL漂白粉溶液中含有的Ca(ClO)2为0.1000×20.00×10—3/4mol;100mL漂白粉溶液中含有的Ca(ClO)2为0.1000×20.00×10—3/4×100/25.00mol,由于m=n?M、Mr[Ca(ClO)2]=143,则100mL漂白粉溶液中含有的0.1000×20.00×10—3/4×100/25.00×143gCa(ClO)2,则漂白粉中Ca(ClO)2的质量分数为0.1000×20.00×10—3/4×100/25.00×143/b×100%。
本题难度:困难
3、实验题 硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl2 BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼:

请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:_______________________。
(2)E装置的作用是_______________________________________。
如果拆去B装置,可能的后果是_______________________________________
_________________________。
(3)写出D装置中发生反应的化学方程式:_____________________________
实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:______________________________;
实验室保存三氯化硼的注意事项是__________________________________。
(5)为了顺利完成实验,正确的操作是________(填序号),并解释原因:________。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:
________________________________________________________________。
参考答案:(1)2MnO4—+10Cl-+16H+=2Mn2++8H2O+5Cl2↑
(2)冷却和收集三氯化硼 硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸
(3)2B+3Cl2 2BCl3 碱石灰
2BCl3 碱石灰
(4)BCl3+3H2O=H3BO3+3HCl↑ 密封保存
(5)① 排尽装置中的空气,避免氧气与硼粉反应生成B2O3
(6)取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉
本题解析:本实验属于物质制备与检验综合设计实验,涉及制备气体、净化气体、干燥气体和尾气处理。(1)见答案。(2)三氯化硼的沸点低,易挥发,需要冷却产品。B装置的作用是吸收Cl2中混有的HCl,由题给资料知,硼与氯化氢反应生成的产物中有氢气,加热氢气和氯气的混合气体,易发生爆炸。(3)硼与氯气在加热条件下反应生成三氯化硼。F装置用于吸收水蒸气,避免G装置中的水蒸气进入U形管。G装置可以盛装氢氧化钠溶液吸收尾气,故实验中可以用一个盛装碱石灰的干燥管来代替F+G装置。(4)因硼与铝的性质相似,硼酸的化学式为H3BO3,类似铝酸(H3AlO3)。因三氯化硼遇水能反应,故实验室应密封保存三氯化硼。(5)若不先排尽装置中的空气,O2会与硼反应:4B+3O2 2B2O3。(6)由题给材料知硼与氢氧化钠溶液反应:2B+2H2O+2NaOH=2NaBO2+3H2↑,三氯化硼溶于氢氧化钠溶液发生反应:BCl3+4NaOH=NaBO2+2H2O+3NaCl。
2B2O3。(6)由题给材料知硼与氢氧化钠溶液反应:2B+2H2O+2NaOH=2NaBO2+3H2↑,三氯化硼溶于氢氧化钠溶液发生反应:BCl3+4NaOH=NaBO2+2H2O+3NaCl。
本题难度:一般
4、选择题 下列除杂质的操作中不正确的是
[? ]
A.铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤
B.FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤
C.Na2CO3固体中混有少量NaHCO3:加入过量NaOH溶液
D.氯气中混有少量氯化氢气体:将混合气体通过盛饱和食盐水的洗气瓶
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列根据实验操作和现象所得出的结论正确的是
选项
| 实验操作
| 实验现象
| 结论
|
A
| 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4溶液
| 均有固体析出
| 蛋白质均发生变性
|
B
| 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液
| 出现白色沉淀
| 溶液X 中一定含有SO42-
|
C
| 向一定浓度的Na2SiO3溶液中通入适量CO2气体
| 出现白色沉淀
| H2SiO3的酸性比H2CO3的酸性强
|
D
| 向浓度均为0. 1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液
| 出现黄色沉淀
| Ksp(AgCl)>Ksp(AgI)
参考答案:D
本题解析:A项,蛋白质中加入NaCl发生盐析,加入CuSO4发生变性,错;B项,若原X中含有SO32-,加入稀HNO3,则会被氧化成SO42-,而与Ba2+生成沉淀,错;C项,反应方程式为:CO2+H2O+Na2SiO3 H2SiO3↓+ Na2CO3,该反应发生的原理为强酸制弱酸,即酸性:H2CO3>H2SiO3,错;D项,反应总是向着更难溶的方向进行,由于AgI的溶度积比AgCl小,所以优先生成AgI,正确。 H2SiO3↓+ Na2CO3,该反应发生的原理为强酸制弱酸,即酸性:H2CO3>H2SiO3,错;D项,反应总是向着更难溶的方向进行,由于AgI的溶度积比AgCl小,所以优先生成AgI,正确。
【考点定位】实验过程的现象及结论分析
本题难度:一般
|