1、填空题 有一固体混合物,可能由NaI、KCl、Na2CO3、Na2SO4、CaCl2、Cu(NO3)2中的一种或几种组成,为了检验所含的物质,做了以下实验:
①取少许固体溶于水,得到无色透明溶液;
②往此溶液中滴加氯化钡溶液,有白色沉淀生成;
③过滤,往沉淀中加入足量的稀硝酸,发现沉淀没有全部溶解且有无色无味的气体生成。
④往滤液中加入足量的新制的氯水,再加入少许汽油,振荡,静置,上层液体呈紫红色。
(1)试判断:固体混合物中肯定含有?,
一定没有?,
可能含有?。
(2)对可能含有的物质,如何进行实验以进一步检验。
?。
(3)实验④中发生的化学反应属于?反应(填反应类型),主要实验操作名称叫?。
参考答案:(1)肯定含有Na2CO3、Na2SO4、NaI, (2分)
一定没有Cu(NO3)2、CaCl2,?(2分)
可能含有KCl?(2分)
(2)做焰色反应,若透过蓝色钴玻璃有紫色火焰,则含KCl;反之,则没有。(2分)
(3)置换反应或氧化还原反应(1分)?萃取(1分)
本题解析:(1)由①,无Cu(NO3)2,且CaCl2和Na2CO3不能同时有;由②,有Na2CO3,无CaCl2;
由③,“部分溶于”有Na2SO4;由④,上层紫红色,上层是苯(萃取,苯密度小于水,易溶解碘),有KI,因此不能确定KCl;因此有Na2SO4,Na2CO3、 KI;无CuCl2、CaCl2,可能有KCl
(2)检验氯化钾,可以做焰色反应。若透过蓝色钴玻璃有紫色火焰,则含KCl;反之,则没有。
(3)实验④中发生的化学反应Cl2+2I-=I2+2Cl-,发生的是氧化还原反应。加入有机溶剂萃取碘单质。
本题难度:一般
2、选择题 为除去下表物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是( )
| 物质 | 选用试剂(过量) | 操作方法
A
Cu(CuO)
氧气
通入氧气并加热
B
CO2(HCl)
饱和碳酸氢钠溶液
通过盛有饱和NaHCO3溶液的洗气瓶
C
CO(H2)
氧化铜
通过灼热的氧化铜
D
KCl溶液(K2CO3)
氯化钙溶液
加入氯化钙溶液充分反应后过滤
|
A.A
B.B
C.C
D.D
参考答案:A.Cu能与氧气在加热条件下生成氧化铜,选用氧气反而会把原物质除去,不符合除杂原则,故A错误;
B.HCl能与碳酸氢钠溶液反应生成氯化钠和二氧化碳,不符合除杂原则,故B正确;
C.一氧化碳和氢气都能与氧化铜反应,将原物质除掉,故C错误;
D.除杂所加的试剂是过量的,引入了新的杂质氯化钙,故D错误.
故选B.
本题解析:
本题难度:简单
3、实验题 FeSO4·7H2O俗称绿矾,广泛用于医药和工监领域。
(1)已知FeSO4·7H2O晶体在加热条件下发生如下反应:
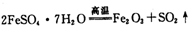
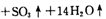 。利用下图装置检验该反应的气体产物。
。利用下图装置检验该反应的气体产物。
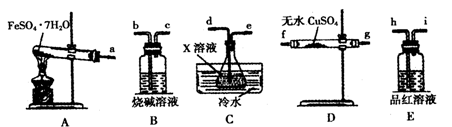
请填写下列空白:
①仪器的连接顺序为?(用a~i的字母表示)。
②装置C中的试剂X化学式为?;该装置中冷水的作用是?。
(2)以下是FeSO4·7H2O的实验窒制备流理图。
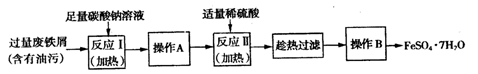
根据题意完成下列填空:
①反应Ⅱ需要l00mL l.5mol·L-1l的稀硫酸溶解洁净的铁屑,用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及?,量取浓硫酸的体积为?。
②反应1需要加热数分钟,其原因是?;操作A为?。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取3.0g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.01000moL·L-1 KMnO4溶液滴定,消耗KMnO4溶液的体积为200.00mL。发生反应的离子方程式为?,计算上述样品中FeSO4·7H2O的质量分数为?(保留两位有效数字)。
参考答案:(15分)(1)①a、f、g、d、e、h、i、b(或a、g、f、d、e、h、i、b)(2分)
②BaCl2(2分)? SO3与H2O的反应是放热反应,降低温度有利于SO3被水吸收(2分)
(2)①100ml容量瓶(1分)(只答容量瓶0分)? 8.2ml(1分)
②升温促进Na2CO3水解,溶液碱性增强,去油污能力强(1分)?过滤、洗涤(2分)
③5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)? 0.93(或93%)(2分)
本题解析:(1)①检验水蒸气一般用无水硫酸铜,检验SO2一般用品红溶液。由于SO2的熔沸点较低,因此SO3气体易被水吸收生成硫酸,可以通过检验硫酸来检验SO3。又因为通过溶液时必然带出水蒸气,所以首先检验水蒸气,其次检验SO3,最后检验SO2,且还要有尾气吸收装置,因此正确的顺序是a、f、g、d、e、h、i、b(或a、g、f、d、e、h、i、b)。
②检验硫酸的试剂可以是氯化钡溶液。又因为SO3与H2O的反应是放热反应,所以装置中冷水的作用是降低温度,便于SO3被水吸收。
(2)①配制一定物质的量浓度溶液时,所用的仪器除了有量筒、烧杯、玻璃棒、胶头滴管以外,还必须有100ml容量瓶。稀释过程中溶质是不变的,所以需要浓硫酸的体积是V=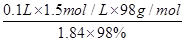 =8.2ml。
=8.2ml。
②由于工业废铁屑中含有酯类油污,所以必须除去酯类油污。碳酸钠溶液显碱性,可以溶解酯类油污达到去除的目的。由于升高温度促进水解,溶液碱性增强,去油污能力增强,所以反应I需要加热数分钟。从溶液中分离铁的操作是过滤,然后洗涤即可,即操作A是过滤、洗涤。
③在反应中高锰酸钾是氧化剂,硫酸亚铁是还原剂,反应的离子方程式是5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。所以根据方程式可知:
5FeSO4·7H2O~KMnO4
5mol? 1mol
n? 0.01000moL/L×0.200L
解得n=0.010mol
所以上述样品中FeSO4·7H2O的质量分数为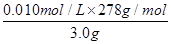 ×100%=93%
×100%=93%
本题难度:一般
4、选择题 下列有关物质检验的实验结论正确的是
选项
| 实验操作及现象
| 实验结论
|
A
| 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
| 该溶液中一定含有SO42-
|
B
| 将某未知溶液中加入2mL2%的CuSO4溶液和数滴NaOH 2%的溶液并加热未见砖红色沉淀产生
| 该溶液中一定不含有醛基
|
C
| 将某气体通入溴水中,溴水褪色
| 该气体一定为不饱和烃
|
D
| 向某溶液中加入NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝
| 该溶液中一定含有NH4+
参考答案:D
本题解析:A、向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀,该白色沉淀可能是硫酸钡或氯化银,因此该溶液中不一定含有SO42-,A不正确;B、配制氢氧化铜悬浊液时氢氧化钠应该是过量的,否则与醛基不能发生氧化还原反应,B不正确;C、能使溴水褪色的物质可以是二氧化硫、不饱和烃等,因此C不正确;D、气体能使湿润的红色石蕊试纸变蓝,该气体一定是氨气,因此该溶液中一定含有NH4+,D正确,答案选D。
本题难度:简单
5、选择题 为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是
序号
| 物质
| 杂质
| 除杂质应选用的试剂或操作方法
| ①
| KNO3溶液
| KOH
| 滴入稀盐酸,同时用pH计测定至溶液呈中性
| ②
| FeSO4溶液
| CuSO4
| 加入过量铁粉并过滤
| ③
| H2 ?
| CO2
| 依次通过盛有NaOH溶液和浓硫酸的洗气瓶
| ④
| Na2SO4
| CaCO3
| 溶解、过滤、蒸发、结晶
|
A.①②③? B.②③④? C.①③④? D.①②③④
参考答案:B
本题解析:考查物质的分离和提纯。选项①中加入盐酸后氢氧化钾转化为氯化钾,因此又引入了新的杂质,①不正确,其余都是正确的,答案选B。
本题难度:一般
|